دوره 34، شماره 5 - ( 5-1402 )
جلد 34 شماره 5 صفحات 246-235 |
برگشت به فهرست نسخه ها
Research code: 4023، 4018
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Forouhandeh H, Nejadali A, Abdi P, Mehdizadeh Aghdam E, Eliasifar B, Dilmaghani A. ISOLATION OF THE BACTERIA PRODUCING PHYTASE, BETA-GLUCANASE, CELLULASE AND GLUTAMINASE FROM SALINE SOIL OF SEMNAN PROVINCE, IRAN. Studies in Medical Sciences 2023; 34 (5) :235-246
URL: http://umj.umsu.ac.ir/article-1-5973-fa.html
URL: http://umj.umsu.ac.ir/article-1-5973-fa.html
فروهنده هاله، نژادعلی امین، عبدی پیمان، مهدیزاده اقدم الناز، الیاسی فر بابک، دیلمقانی آزیتا. جداسازی باکتریهای تولیدکننده آنزیمهای فیتاز، بتاگلوکاناز، سلولاز و گلوتامیناز از خاک شور استان سمنان. مجله مطالعات علوم پزشکی. 1402; 34 (5) :235-246
دانشیار بیوتکنولوژی داروئی، مرکز تحقیقات بیماریهای عفونی و گرمسیری، دانشگاه علوم پزشکی تبریز، تبریز،ایران (نویسنده مسئول) ، dilmaghania@tbzmed.ac.ir
متن کامل [PDF 470 kb]
(1700 دریافت)
| چکیده (HTML) (3141 مشاهده)
جدول (1): نتایج توانایی تولید آنزیمهای هیدرولایتیک بهوسیله باکتریهای نمک دوست جداسازی شده
تأثیر pH و دما بر فعالیت آنزیم گلوتامیناز:
تأثیر pH بر عملکرد آنزیم گلوتامیناز موردبررسی قرار گرفت و سپس میزان جذب نوری در طولموج nm 480 اندازه گیری شد. نتایج نشان داد pH بهینه برای فعالیت آنزیم گلوتامیناز جدا شده از باکتریهای نمک دوست، 8 pH است. همچنین بر اساس نتایج به دست آمده، بهترین دما برای فعالیت آنزیم سلولاز در سویه جداشده، 40 درجه سانتیگراد در نظر گرفته شد.
تأثیر pH و دما بر فعالیت آنزیم بتاگلوکاناز:
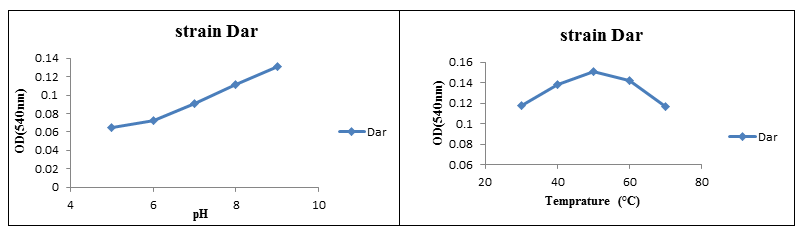
بر طبق نتایج حاصله، دو سویه جداشده از باکتریهای نمک دوست، شامل سویه D6A و سویه Dar قابلیت تولید آنزیم بتاگلوکاناز را نشان دادند. در بررسی تأثیر pH بر عملکرد آنزیم بتاگلوکاناز بر روی این دو سویه، مشخص گردید که pH بهینه برای فعالیت آنزیم بتاگلوکاناز در سویه D6A، 9pH و بهترین دما برای فعالیت این آنزیم 50 درجه سانتیگراد میباشد. نتایج برای سویه Dar نیز مشابه با سویه قبلی گزارش گردید، بدین ترتیب که pH بهینه برابر با 9 pH و دمای بهینه 50 درجه سانتیگراد ثبت گردید.
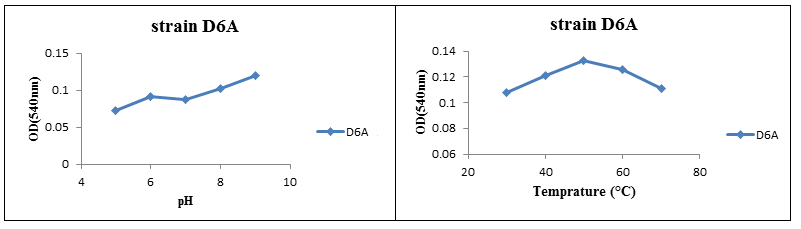
شکل (5): تأثیر pH و دما بر فعالیت آنزیم بتاگلوکاناز در سویه D6A
بحث
مناطق نمکی و فوق اشباع از نمک در سراسر کره زمین، همچون دریاچههای نمک و یا معادن نمک وجود دارند. این مناطق نمکی شرایط بسیار سخت برای زیستن موجودات عادی فراهم میکنند. این در حالیست که تعدادی از میکروارگانیسمها شامل گروهی از باکتریها و آرکی باکتریها، قابلیت زیستن در این شرایط دشوار را دارند. آنزیمهای هیدرولایتیک تولید شده توسط این میکروارگانیسمها خصوصیات منحصر به فردی شامل مقاومت به شوری، دما و غیره را از خود نشان میدهند (17).
آنزیمهای هیدرولایتیک ازجمله ترکیبات مهم در صنعت داروسازی و پزشکی به شمار میروند که در سالهای اخیر تولیدات میکروبی آنها بسیار مورد توجه قرار گرفته است. در حال حاضر تولید 80 درصد کل آنزیمهای مورد استفاده در این صنعت به کمک میکروارگانیسمها صورت میگیرد. مشخص گردیده است که اکثر آنزیمهای تولید شده توسط میکروارگانیسمها کاربردیتر از آنزیمهای مشتق شده توسط گیاهان و حیوانات میباشند که این امر میتواند به علت تنوع فعالیت کاتالیکی، بازده بالا، سهولت در دستکاری ژنتیکی، فراورده منظم و رشد سریع میکروارگانیسم در محیطهای کم هزینه باشد (18, 19).
فرایندهای صنعتی معمولاً تحت شرایط فیزیکی و شیمیایی انجام میشوند که برای فعالیت آنزیمهای صنعتی مطلوب و بهینه نیستند، به همین دلیل آنزیمهایی که بتوانند بهینه فعالیت خود را در شرایط دشوار ازنظر دما و نمک نشان دهند، ازاهمیت بسیار بالایی برخوردار میباشند. باکتریهای نمک دوست منبع چنین آنزیمهایی هستند، در حقیقت آنزیمهای به دست آمده از این میکروارگانیسمها، نه تنها غلظت بالای نمک را تحمل میکنند، بلکه بسیاری از آنها نسبت به حرارت نیز متحملتر میباشند. شناسایی باکتریهای نمک دوستی که توانایی ویژهای در تولید آنزیمهای خارج سلولی دارند، این امکان را فراهم میکند که بتوان آنزیمهایی به دست آورد که فعالیت بهینه در غلظتهای مختلف نمک و دماهای بالا داشته باشند (20). ازجمله آنزیمهای هیدرولایتیک مهم که باکتریهای نمک دوست توانایی تولید آنها را دارند آنزیم بتاگلوکاناز است که کاربرد گستردهای در کاغذ سازی، صنایع غذایی و صنایع خوراکی و دارویی دارد (21).
در این تحقیق باکتریهای نمک دوست از خاک نمکی بیابانهای فلات مرکزی ایران جداسازی شد و تولید آنزیمهای فیتاز، سلولاز، گلوتامیناز و بتاگلوکاناز بر روی آنها بررسی شد، سپس تأثیر دما و pH روی این آنزیمها مورد ارزیابی قرار گرفت.
نتایج حاصل از پژوهش انجام شده، نشان داد که هیچکدام از سویههای جدا شده از باکتریهای نمک دوست، توانایی تولید آنزیم فیتاز را ندارند. این در حالیست که چندین سویه قادر به تولید آنزیمهای سلولاز، گلوتامیناز و بتاگلوکاناز بودند.
بررسی فعالیت کاتالیتیکی آنزیم بتاگلوکاناز تولید شده بهوسیله باکتری Bacillus subtilis، کلونینگ ژن تولیدکننده β-1,3-1,4-glucanase از باکتری Bacillus licheniformis (CGMCC 0635)، بررسی خصوصیات آنزیم بتاگلوکوناز بهوسیله باکتری Bacillus subtilis (GN156) و تولید آنزیم بتاگلوکاناز بهوسیله Bacillus halodurans C-125 ازجمله پژوهشهایی است که بر روی میکروارگانیسمهای تولیدکننده آنزیم بتاگلوکاناز انجام گردیده است. در پژوهشی که در باکتریهای نمک دوست نسبی Bacillus sp. L1 از منطقه Yuncheng کشور چین جداسازی شده بود، این باکتری توانایی تولید آنزیم سلولاز را داشت. آنزیم سلولاز تولید شده بهترین pH برای فعالیت این آنزیم 8 و بهترین دمای فعالیت 60 درجه سانتیگراد به دست آمد و همچنین بهترین دمای پایداری آن در 80-30 درجه سانتیگراد و بهترین pH برای پایداری آنزیم 9-7 بود (22). در پژوهشی که بر روی باکتریهای نمک دوست Gracilibacillus sp. SK1 جدا شده از خاک دریاچه Yuncheng انجام شد، باکتریهای نمکدوست جداسازی شده توانایی تولید آنزیم سلولاز مقاوم به شرایط قلیایی را داشتند. بهترین pH برای فعالیت آنزیم سلولاز تولید شده بهوسیله این باکتری 8 و بهترین دمای فعالیتش 60 درجه سانتیگراد بود. این آنزیم در رنج دمایی 70-40 درجه سانتیگراد و pH 10-6 پایدار بود (23).
در پژوهشی که باکتری تولیدکننده آنزیم گلوتامیناز از Gangotri Region جداسازی شده بود، بهترین pH برای فعالیت آنزیم جداسازی شده 11 و بهترین دمای فعالیت 70 بود. همچنین بهتری pH پایداری آنزیم 11-8 و بهتری دمای پایداری آن 50 درجه سانتیگراد بود. باکتری جداسازی شده متعلق به خانواده Bacillus بود (24). در پژوهشی باکتری Lactobacillus rhamnosus توانایی تولید آنزیم گلوتامیناز داشت که این آنزیم مقاوم به شرایط نمکی و دما بود. بهترین pH برای فعالیت آنزیم گلوتامیناز جداسازی شده 7 و بهترین دمای فعالیت 50 درجه سانتیگراد بود (25). در پژوهش حاضر باکتری نمکدوست تولیدکننده آنزیم گلوتامیناز متعلق به خانواده Bacillus بود که بهترین pH برای فعالیت آنزیم گلوتامیناز تولید شده بهوسیله این باکتری 8 و بهترین دمای فعالیتش 50 درجه سانتیگراد بود و همچنین بهترین دمای پایداری آن در 60 درجه سانتیگراد و بهترین pH برای پایداری آنزیم 8 بود. در پژوهش حاضر باکتری نمکدوست تولیدکننده آنزیم گلوتامیناز متعلق به خانواده Bacillus بود که بهترین pH برای فعالیت آنزیم گلوتامیناز تولید شده بهوسیله این باکتری 8 و بهترین دمای فعالیتش 50 درجه سانتیگراد بود و همچنین بهترین دمای پایداری آن در 60 درجه سانتیگراد و بهترین pH برای پایداری آنزیم 8 بود.
در پژوهشی که بهوسیله شعله ده پهلوان و همکارانش در سال 1395 انجام شد، باکتری باسیلوس سوبتلیس B5d از فیلوسفر باغات سیب استان کرمان جداسازی شد که تولید آنزیم بتاگلوکوناز بهوسیله آن در سال 1395 بررسی شد. در این پژوهش نشان داده که بیشترین فعالیت کاتالیتیکی آنزیم بتاگلوکوناز در دمای 50 درجه سانتیگراد و بهترین pH برای آن 6 بوده است (26).
در پژوهشی که توسط Gilvan Pessoa Furtado و همکارانش در سال 2011 بر روی باکتری Bacillus subtilis 168 انجام شد نشان داد که بهترین فعالیت کاتالیتیکی آنزیم بتاگلوکوناز در دمای 50 درجه سانتیگراد و بهترین pH فعالیت کاتالیتیکی آن 6 است (27). در پژوهشی که بهوسیله Da Teng و همکارانش در سال 2006 بر روی تولید آنزیم β-1,3-1,4-glucanase از Bacillus licheniformis EGW039 (CGMCC 0635) انجام شد، که نتایج بهترین دمای فعالیت کاتالیتیکی آنزیم β-1,3-1,4-glucanase 40 درجه سانتیگراد و بهتری pH برای فعالیت کاتالیتیکی این آنزیم 6/5 بود (28). در پژوهشی که در سال 2006 بر روی باکتری Bacillus subtilis GN156 بهوسیله Jirawan Apiraksakorn و همکارانش فعالیت کاتالیتیکی آنزیم β-1,3-1,4-glucanase بررسی شده نشان داد بهترین دمای فعالیت کاتالیتیکی آنزیم β-1,3-1,4-glucanase 65 درجه سانتیگراد و بهتری pH برای فعالیت کاتالیتیکی این آنزیم 7 بود (29). در پژوهش پنجم Masatake Akita و همکارانش در سال 2005 بر روی باکتری Bacillus halodurans C-125 نشان داده شد که این باکتری که توانایی تولید آنزیم بتاگلوکوناز دارد، بهترین دمای فعالیت کاتالیتیکی آن 60 درجه سانتیگراد و بهترین pH 6 بود (30).
این نتایج نشان داد که آنزیم بتاگلوکاناز تولید شده بهوسیله باکتریهای نمک دوست جداسازی شده، بهترین فعالیت کاتالیتیکی خود را در pH قلیایی نشان میدهند که میتواند بسیار ارزشمند باشد زیرا در شرایط سخت، آنزیم بتاگلوکاناز توانایی انجام دادن بهترین عملکردش را دارد. بی تردید خاک منبع مهمی جهت جداسازی میکروارگانیسمهای تولیدکننده آنزیمهای صنعتی است. کشور ما با توجه به تنوع اقلیمی، دارای منابع بسیار غنی است. با جداسازی و شناسایی سویههای بومی برتر تولیدکننده آنزیمهای صنعتی و اعمال روشهای مهندسی زیستی، میتوان جهت بومی سازی و بهینهسازی این آنزیمها گام موثری در صنایع داروسازی و پزشکی برداشت. در این مطالعه گونههای مختلف بومی ایران معرفی شدند. کاملاً محرز است که بررسی و شناسایی باکتریهای بومی خصوصاً در مناطق دست نیافتنی و بکر، بهعنوان ذخایر ژنتیکی کشور و ثروت ملی سرزمینمان، بسیار حائز اهمیت خواهد بود.
نتیجهگیری
نتایج حاصل از تحقیق مشخص کرد که باکتریهای نمک دوست جداسازی شده از خاک بیابانهای نمکی مرکز ایران توانایی تولید آنزیمهای هیدرولایتیک همچون گلوتامیناز، سلولاز و بتاگلوکاناز را دارند و میتوانند منبع مناسبی جهت تولید آنزیمهایی با خواص منحصر به فرد مانند، مقاومت به شوری باشند که برای کارهای صنعتی و پژوهشی خصوصاً داروسازی صنعتی مورد استفاده قرار گیرند. بنابراین تحقیقات بیشتر جهت دستیابی به شرایط بهینه تولید و تجاری سازی این آنزیمها توسط جدایههای مذکور، موردنیاز بوده و توصیه میگردد.
تشکر و قدردانی
این مقاله مستخرج از پایانامه های دکتری عمومی دانشکده داروسازی دانشگاه علوم پزشکی تبریز با شماره پایاننامه های 4023، 4018 است.
ملاحظات اخلاقی
با توجه به اینکه این مطالعه بر روی نمونههای جانوری یا انسانی انجام نیافته است، لذا ملاحظات اخلاقی مربوطه در این پژوهش موضوعیت ندارد.
منابع مالی
این پژوهش با هزینه مالی نویسنده مسئول انجام یافته است.
منابع متقابل
مؤلف اظهار میدارد که منافع متقابلی از تألیف یا انتشار این مقاله ندارد.
مشارکت مولفان
همکاران اجرا و تحلیل نتایج مطالعه را برعهده داشتند. آ.د همچنین مقاله را تألیف نموده و نسخه نهایی آن را مطالعه و تأیید نموده است.
متن کامل: (1170 مشاهده)
مقدمه
مناطقی با شوری بالا بهعنوان یک نمونه از مناطق با شرایط زیست دشوار هستند که میکروارگانیسمهای زنده در این مناطق توانایی زیست در رنج بالاتری از غلظت نمک را دارند (1). کوشنر، باکتریهای نمک دوست را بر اساس غلظت نمک که در آن زیست میکنند به گروههای مختلف تقسیم کرد که شامل باکتری نمک دوست خفیف که بهترین رشد را در 1 تا 3 درصد نمک طعام دارند. باکتری نمک دوست معتدل که بهترین رشد را در 3 تا 15 درصد نمک طعام دارند و باکتری نمک دوست افراطی که رشد مطلوبتری را در 15 تا 30 درصد نمک طعام دارند. موجودات غیر نمک دوست به کمتر از 1 درصد نمک طعام نیاز دارند، درحالیکه اگر این میکروارگانیسمها نیز غلظت بالای نمک را تحمل میکردند بهعنوان تحملکننده نمک در نظر گرفته میشدند (2, 3).
باکتریهای نمک دوست دارای پتانسیلهای کاربردی در زمینههای مختلف صنعت، اکولوژی و بیوتکنولوژی هستند. امروزه توجه به آنزیمهای میکروارگانیسمهای نمک دوست و کاریردهای زیستفناوریشان افزایش یافته است. یکی از مهمترین کاربردهای میکروارگانیسمهای نمک دوست در تولید آنزیمهای هیدرولایتیک است که توانایی انجام واکنش در شرایط سخت را دارند، از مهمترین آنزیمهایی که کاربرد فراوانی در صنایع مختلف دارند میتوان به فیتاز، گلوکاناز، سلولاز و گلوتامیناز اشاره کرد. مکمل فیتاز غذایی با منشأ میکروبی با تجزیه فیتات، اثر ممانعتی جذب مواد معدنی توسط آن را برطرف نموده و از تشکیل این کمپلکسها جلوگیری میکند و با افزایش جذب فسفات از عناصر غذایی، باعث جلوگیری از دفع فسفات میشود (4, 5). علاوه بر این گزارش شده است که آنزیم فیتاز تأثیر مثبتی بر روی قابلیت هضم پروتئین، جذب غذایی، نسبت غذا به محصول، انرژی متابولیزه شونده، بقای فسفر، نیتروژن و کلسیم دارد (6, 7). همچنین از فیتاز میتوان در صنایع داروسازی در درمان بیماری آّلزایمر، کاهش کلسترول و جلوگیری از تشکیل سنگ کلیه استفاده کرد. بنابراین فیتاز، پتانسیل وسیعی در کاربردهای بیوتکنولوژی داروئی و پزشکی دارد و میتواند مشکلات زیادی را در زمینه سلامتی و محیطزیست برطرف کند (8).
سلولز، همی سلولز و لیگنین بخشهای اصلی تشکیلدهنده دیواره سلولی گیاهان بوده که به ترتیب 40، 33 و 23 درصد از وزن خشک گیاه را تشکیل میدهند. گلوکان یکی از اجزای اصلی سلولز، در دیواره سلولی گیاهان میباشد و دومین پلی ساکارید به لحاظ فراوانی پس از سلولز است. ازاینرو میکروارگانیسمهای تجزیهکننده گلوکان، توزیع فراوانی در خاک، کمپوست، روده حیوانات گیاهخوار، حشرات و بیمهرگان دارند (9). اندو-بتا-1 و 4 گلوکاناز میکروبی ازجمله آنزیمهای کلیدی برای تجزیه گلوکان است (10). نقش اصلی آنزیم اندوگلوکاناز شکستن زنجیره سلولزی و تبدیل آن به قندهای کوچکتر همچون گلوکز و سلودکسترین است (11). سلولاز یکی از پرکاربردترین آنزیمها در صنعت میباشد. این آنزیم میتواند توسط قارچها، باکتریها و یا اکتینومیستها تولید شود. هزینه بالای تولید سلولاز به علت قیمت زیاد سوبسترای مورداستفاده در تولید و همچنین سرعت پایین رشد قارچها میباشد. باکتریها به علت سرعت رشد بالا در مقایسه با قارچها، برای تولید سلولاز مناسبترند. سلولاز باکتریایی عمدتاً فاقد فعالیت FPase است. اما ازلحاظ کاتالیتیکی مؤثرتر است. همچنین این سلولاز کمتر بهوسیله مواد هیدرولیز شده مهار میگردد (12).
L-Glutaminas یک آنزیم هیدرولایتیک است که باعث تبدیلشدن ال-گلوتامین به گلوتامیک اسید و آمونیوم میشود (13). L-Glutaminase پتانسیل خوبی بر علیه سرطان دارد و بهعنوان طعمدهنده در صنایع غذایی استفاده میشود و باعث افزایش ترکیبات اسید گلوتامیک دار در غذا میشود. گلوتامیناز مقاوم به نمک و مقاوم به دما در صنایع غذایی موردنیاز است. برخی میکروارگانیسمهای نمک دوست همچون میکروارگانیسمهایی که از دریا جداسازی میشوند توانایی تولید آنزیم گلوتامیناز مقاوم به نمک دارند. باکتریهای مختلف همچون Pseudomonas sp.، Vibrio costicola و Micrococcus sp که از دریا جداسازی شدهاند توانایی تولید آنزیم گلوتامیناز مقاوم به نمک دارند. همچنین قارچهایی همچون Aspergillus oryzae میتواند این آنزیم را تولید کند (14). با توجه به کاربردهای تجاری فیتاز، گلوکاناز، سلولاز و گلوتامیناز، سالانه هزینههای زیادی صرف واردات و خرید این آنزیمها در کشور میگردد. تولید آنزیم از سویههای بومی نیازمند مطالعات و بررسی در مناطق مختلف ایران است. هدف پژوهش حاضر، بررسی جداسازی و شناسایی آنزیمهای فیتاز، گلوکاناز، سلولاز و گلوتامیناز از باکتریهای نمک دوست جداسازی شده از فلات مرکزی ایران است.
مواد و روش کار
نمونهبرداری:
نمونه مطالعه کیفی و مستقل هست نمونهبرداری از اعماق 0-30 سانتیمتری خاکهای دو منطقه حاج علی گول و بیارجمند استان سمنان انجام گرفت. نمونههای منتقلشده به آزمایشگاه برای جداسازی باکتریهای نمک دوست، تا رقت 6-10 سری رقیقسازی شدند. نمونه مطالعه کیفی و مستقل است. برای جداسازی باکتریهای نمک دوست، از محیط کشت نوترینت براث (گرم در لیتر) کلرید پتاسیم 2، کلرید کلسیم 6/3، سولفات منیزیم 7 آبه 9.7، نمک 81، کلرید منیزیم 6 آبه 7، برمید سدیم 026/0، بیکربنات سدیم 06/0 استفاده شد (15). نمونههای مربوطه در 100 سیسی محیط کشت نوترینت براث، در دمای 28 درجه سانتیگراد در انکوباتور شیکردار با دور rpm150 به مدت 72 ساعت قرار گرفتند. پس از مشاهده کدورت رشد در محیط کشت مایع نمکی، نمونهها در محیط کشت جامد نوترینت با روش کشت خطی کشت داده شده و به مدت 48 تا 72 ساعت در دمای 28 درجه سانتیگراد گرماگذاری شدند.
بررسی تولید و سنجش فعالیت آنزیم سلولاز:
محیط کشت مورداستفاده برای بررسی تولید آنزیم سلولاز حاوی 5 گرم CMC، 1 گرم NaNO3، 2 گرم KH2PO4، 1 گرم KCl، 5/0 گرم MgSO4.، 10 درصد نمک میباشد. 15 گرم آگار برای جامد کردن محیط کشت بر یک لیتر آب مقطر دیونیزه اضافه گردید. باکتریهای نمک دوست در محیط موردنظر کشت داده شدند و به مدت 48 ساعت در دمای 28 درجه سانتیگراد انکوبه شدند. بعد از 48 ساعت انکوباسیون به آنها معرف کنکورد 1/0 درصد اضافه شد و سپس با محلول 1 مولار NaCl شستشو داده شدند. ایجاد هاله شفاف در اطراف محیط کشت نشاندهنده تولید آنزیم سلولاز در نظر گرفته شد.
بررسی تولید و سنجش فعالیت آنزیم گلوتامیناز:
برای بررسی تولید آنزیم گلوتامیناز، باکتریهای نمک دوست در محیط کشت حاوی 2 گرم Na2HPO4، 3 گرم KH2PO4، 5 گرم L-glutamin، 5/0 گرم MgSO4، 15/0 گرم CaCl2،2 گرم گلوگز و 15 گرم آگار به همراه 10 درصد NaCl بر یک لیتر آب مقطر دیونیزه اضافه گردید. پس از اتوکلاو و استریل کردن محیط و آمادهسازی در پتری دیشهای مخصوص کشت باکتریایی، باکتریها کشت داده شدند. در مرحله بعدی 5/2 سیسی محلول استوک شامل 3 درصد برموتیمول به لو در اتانول بهعنوان اندیکاتور pH ریخته شد و سپس به مدت 48 ساعت در دمای 37 درجه سانتیگراد انکوبه گردید. ایجاد تغییر رنگ اطراف کلنی نشان از تولید گلوتامیناز دارد.
بررسی تولید و سنجش فعالیت آنزیم فیتاز:
برای بررسی تولید آنزیم فیتاز محیط کشت حاوی 3 گرم (NH4)2SO4، 5/0 گرم MgSO4، 5 گرم Ca-phytate، 1/0 گرم CaCl2، 01/0 گرم MnSO4، 1/0 گرم FeSO4، 10 گرم گلوگز و 20 گرم آگار باکتریایی که در یک لیتر آب مقطر دیونیزه حل و استریل گردیده بود استفاده شد. محیطهای کشت حاوی باکتری به مدت 72 ساعت در دمای 37 درجه انکوبه شدند. وجود هاله شفاف در اطراف کلنی، نشاندهنده تولید آنزیم فیتاز بهوسیله باکتریهای نمک دوست جداسازی شده است.
بررسی تولید آنزیم و سنجش فعالیت آنزیم بتاگلوکاناز:
بهمنظور بررسی توانایی تولید آنزیم بتاگلوکاناز از محیط کشت LB Lysogeny broth حاوی 02/0 درصد لچینن (1,3:1,4-B-D-Glucan) بهعنوان سوبسترای آنزیم بتاگلوکاناز استفاده شد. محیط کشت مخصوص آنزیم بتاگلوکاناز حاوی 4 گرم عصاره مخمر، 10 گرم مالت، 3 گرم عصاره گوشت، 3/0 گرم MgSO4، 5/0 گرم CaCl2، 1 گرم K2HPO4 در یک لیتر آب مقطر دیونیزه میباشد. محیط کشتهای حاصل به مدت 48 ساعت در دمای 37 درجه انکوبه شدند. وجود هاله شفاف پس از افزودن معرف کنگورد نشاندهنده توانایی باکتری در تولید آنزیم بتاگلوکاناز است.
بررسی فعالیت کاتالیتیکی آنزیمها:
برای بهینهسازی شرایط واکنش، ابتدا واکنش آنزیمی در pH های مختلف اسیدی و بازی شامل 4، 5، 6، 7، 8، 9 و 10 موردبررسی قرار گرفت. در این آزمایشها برای تنظیم pH های اسیدی از بافر محلول اسیدسیتریک 1/0 مولار و تری سدیم سیترات 1/0 مولار و جهت تنظیم 7=pH از بافر فسفات 1/0 مولار و برای تنظیم pH های قلیایی از بافرتریس 1/0 مولار استفاده گردید.
بهمنظور بررسی دما 250 میکرولیتر از باکتریهای نمک دوست در 5 لوله آزمایش ریخته شد و به هرکدام از لولهها 500 میکرولیتر از بافر با pH بهینهشده و 1 سیسی از محلول بتاگلوکان 1 درصد اضافه شد. سپس لولهها به در دماهای 30، 40،50،60،70 درجه در انکوباتور به مدت یک ساعت گذاشته شدند. بعد از یک ساعت لولهها از انکوباتور برداشته شدند و به هر لوله 1 سیسی دی-نیتروسالیسیلیک اسید اضافه گردید و به مدت 5 دقیقه در حمام آب جوش قرار داده شدند. درنهایت جذب آنها در طولموج 540 نانومتر خوانده شد.
استخراج DNA و تکثیر قطعه 16S rRNA باکتریها با استفاده از PCR:
استخراج DNA باکتریها با استفاده از کیت استخراج DNA کیاژن انجام گرفت. واکنش زنجیرهای پلیمراز با حجم نهایی 25 میکرولیتر حاوی 10 نانوگرم بر میکرولیتر DNA، 4/0 میلی مولار dNTP، 2 میلی مولار کلرید منیزیم، 5/2 میکرولیتر بافر PCR و 1 واحد آنزیم Taq DNA Polymerase انجام گردید. واکنش PCR با روش استاندارد و با استفاده از پرایمرهای عمومی (F: 5’-AGAGTTTGATCCTGGCTCAG-3’, R: 5’-GACGGGCGGTGTGTACAA-3’) در دستگاه ترمال سایکلر (Eppendorf, Germany) تحت شرایط دمایی 5 دقیقه واسرشت شدن اولیه در دمای 94 درجه سانتیگراد و ادامه 40 چرخه شامل واسرشت در دمای 94 درجه سانتیگراد به مدت 1 دقیقه، اتصال در دمای 45 درجه سانتیگراد به مدت 30 ثانیه، طویل شدن در دمای 72 درجه سانتیگراد به مدت 90 ثانیه و درنهایت طویل شدن نهایی در دمای 72 درجه سانتیگراد به مدت 5 دقیقه انجام گرفت (16). درنهایت، قطعه تکثیر شده جهت تعیین توالی به شرکت تکاپوزیست ارسال گردید. ژنهای توالی یابی شده با 16SrRNA مرجع موجود در NCBI مقابسه شد.
یافتهها
جداسازی و شناسایی باکتریهای تولیدکننده آنزیمهای فیتاز، گلوکاناز، سلولاز و گلوتامیناز:
مطالعه حاضرجهت بررسی توانایی تولید آنزیمهایی هیدرولایتیک بر روی باکتریهای نمک دوست موردنظر انجام شد. از مجموع هفت باکتری جدا شده از خاک مرکزی ایران، تعدادی از باکتریهای نمک دوست برای تولید آنزیمهای گلوکاناز، سلولاز و گلوتامیناز مثبت بودند. این جدایهها بر اساس نتایج حاصل از تکثیر قطعه S rDNA 16 در اندازهای تقریبی 1500 جفت باز، با استفاده از تعیین توالی و بلاست انفورماتیکی در پایگاههای ژن جهانی (https://www.ncbi.nlm.nih.gov) شناسایی گردیدند. نتایج به دست آمده مربوط به جنس و گونه باکتریهای جداسازی شده در جدول 1 آورده شدهاند.
مناطقی با شوری بالا بهعنوان یک نمونه از مناطق با شرایط زیست دشوار هستند که میکروارگانیسمهای زنده در این مناطق توانایی زیست در رنج بالاتری از غلظت نمک را دارند (1). کوشنر، باکتریهای نمک دوست را بر اساس غلظت نمک که در آن زیست میکنند به گروههای مختلف تقسیم کرد که شامل باکتری نمک دوست خفیف که بهترین رشد را در 1 تا 3 درصد نمک طعام دارند. باکتری نمک دوست معتدل که بهترین رشد را در 3 تا 15 درصد نمک طعام دارند و باکتری نمک دوست افراطی که رشد مطلوبتری را در 15 تا 30 درصد نمک طعام دارند. موجودات غیر نمک دوست به کمتر از 1 درصد نمک طعام نیاز دارند، درحالیکه اگر این میکروارگانیسمها نیز غلظت بالای نمک را تحمل میکردند بهعنوان تحملکننده نمک در نظر گرفته میشدند (2, 3).
باکتریهای نمک دوست دارای پتانسیلهای کاربردی در زمینههای مختلف صنعت، اکولوژی و بیوتکنولوژی هستند. امروزه توجه به آنزیمهای میکروارگانیسمهای نمک دوست و کاریردهای زیستفناوریشان افزایش یافته است. یکی از مهمترین کاربردهای میکروارگانیسمهای نمک دوست در تولید آنزیمهای هیدرولایتیک است که توانایی انجام واکنش در شرایط سخت را دارند، از مهمترین آنزیمهایی که کاربرد فراوانی در صنایع مختلف دارند میتوان به فیتاز، گلوکاناز، سلولاز و گلوتامیناز اشاره کرد. مکمل فیتاز غذایی با منشأ میکروبی با تجزیه فیتات، اثر ممانعتی جذب مواد معدنی توسط آن را برطرف نموده و از تشکیل این کمپلکسها جلوگیری میکند و با افزایش جذب فسفات از عناصر غذایی، باعث جلوگیری از دفع فسفات میشود (4, 5). علاوه بر این گزارش شده است که آنزیم فیتاز تأثیر مثبتی بر روی قابلیت هضم پروتئین، جذب غذایی، نسبت غذا به محصول، انرژی متابولیزه شونده، بقای فسفر، نیتروژن و کلسیم دارد (6, 7). همچنین از فیتاز میتوان در صنایع داروسازی در درمان بیماری آّلزایمر، کاهش کلسترول و جلوگیری از تشکیل سنگ کلیه استفاده کرد. بنابراین فیتاز، پتانسیل وسیعی در کاربردهای بیوتکنولوژی داروئی و پزشکی دارد و میتواند مشکلات زیادی را در زمینه سلامتی و محیطزیست برطرف کند (8).
سلولز، همی سلولز و لیگنین بخشهای اصلی تشکیلدهنده دیواره سلولی گیاهان بوده که به ترتیب 40، 33 و 23 درصد از وزن خشک گیاه را تشکیل میدهند. گلوکان یکی از اجزای اصلی سلولز، در دیواره سلولی گیاهان میباشد و دومین پلی ساکارید به لحاظ فراوانی پس از سلولز است. ازاینرو میکروارگانیسمهای تجزیهکننده گلوکان، توزیع فراوانی در خاک، کمپوست، روده حیوانات گیاهخوار، حشرات و بیمهرگان دارند (9). اندو-بتا-1 و 4 گلوکاناز میکروبی ازجمله آنزیمهای کلیدی برای تجزیه گلوکان است (10). نقش اصلی آنزیم اندوگلوکاناز شکستن زنجیره سلولزی و تبدیل آن به قندهای کوچکتر همچون گلوکز و سلودکسترین است (11). سلولاز یکی از پرکاربردترین آنزیمها در صنعت میباشد. این آنزیم میتواند توسط قارچها، باکتریها و یا اکتینومیستها تولید شود. هزینه بالای تولید سلولاز به علت قیمت زیاد سوبسترای مورداستفاده در تولید و همچنین سرعت پایین رشد قارچها میباشد. باکتریها به علت سرعت رشد بالا در مقایسه با قارچها، برای تولید سلولاز مناسبترند. سلولاز باکتریایی عمدتاً فاقد فعالیت FPase است. اما ازلحاظ کاتالیتیکی مؤثرتر است. همچنین این سلولاز کمتر بهوسیله مواد هیدرولیز شده مهار میگردد (12).
L-Glutaminas یک آنزیم هیدرولایتیک است که باعث تبدیلشدن ال-گلوتامین به گلوتامیک اسید و آمونیوم میشود (13). L-Glutaminase پتانسیل خوبی بر علیه سرطان دارد و بهعنوان طعمدهنده در صنایع غذایی استفاده میشود و باعث افزایش ترکیبات اسید گلوتامیک دار در غذا میشود. گلوتامیناز مقاوم به نمک و مقاوم به دما در صنایع غذایی موردنیاز است. برخی میکروارگانیسمهای نمک دوست همچون میکروارگانیسمهایی که از دریا جداسازی میشوند توانایی تولید آنزیم گلوتامیناز مقاوم به نمک دارند. باکتریهای مختلف همچون Pseudomonas sp.، Vibrio costicola و Micrococcus sp که از دریا جداسازی شدهاند توانایی تولید آنزیم گلوتامیناز مقاوم به نمک دارند. همچنین قارچهایی همچون Aspergillus oryzae میتواند این آنزیم را تولید کند (14). با توجه به کاربردهای تجاری فیتاز، گلوکاناز، سلولاز و گلوتامیناز، سالانه هزینههای زیادی صرف واردات و خرید این آنزیمها در کشور میگردد. تولید آنزیم از سویههای بومی نیازمند مطالعات و بررسی در مناطق مختلف ایران است. هدف پژوهش حاضر، بررسی جداسازی و شناسایی آنزیمهای فیتاز، گلوکاناز، سلولاز و گلوتامیناز از باکتریهای نمک دوست جداسازی شده از فلات مرکزی ایران است.
مواد و روش کار
نمونهبرداری:
نمونه مطالعه کیفی و مستقل هست نمونهبرداری از اعماق 0-30 سانتیمتری خاکهای دو منطقه حاج علی گول و بیارجمند استان سمنان انجام گرفت. نمونههای منتقلشده به آزمایشگاه برای جداسازی باکتریهای نمک دوست، تا رقت 6-10 سری رقیقسازی شدند. نمونه مطالعه کیفی و مستقل است. برای جداسازی باکتریهای نمک دوست، از محیط کشت نوترینت براث (گرم در لیتر) کلرید پتاسیم 2، کلرید کلسیم 6/3، سولفات منیزیم 7 آبه 9.7، نمک 81، کلرید منیزیم 6 آبه 7، برمید سدیم 026/0، بیکربنات سدیم 06/0 استفاده شد (15). نمونههای مربوطه در 100 سیسی محیط کشت نوترینت براث، در دمای 28 درجه سانتیگراد در انکوباتور شیکردار با دور rpm150 به مدت 72 ساعت قرار گرفتند. پس از مشاهده کدورت رشد در محیط کشت مایع نمکی، نمونهها در محیط کشت جامد نوترینت با روش کشت خطی کشت داده شده و به مدت 48 تا 72 ساعت در دمای 28 درجه سانتیگراد گرماگذاری شدند.
بررسی تولید و سنجش فعالیت آنزیم سلولاز:
محیط کشت مورداستفاده برای بررسی تولید آنزیم سلولاز حاوی 5 گرم CMC، 1 گرم NaNO3، 2 گرم KH2PO4، 1 گرم KCl، 5/0 گرم MgSO4.، 10 درصد نمک میباشد. 15 گرم آگار برای جامد کردن محیط کشت بر یک لیتر آب مقطر دیونیزه اضافه گردید. باکتریهای نمک دوست در محیط موردنظر کشت داده شدند و به مدت 48 ساعت در دمای 28 درجه سانتیگراد انکوبه شدند. بعد از 48 ساعت انکوباسیون به آنها معرف کنکورد 1/0 درصد اضافه شد و سپس با محلول 1 مولار NaCl شستشو داده شدند. ایجاد هاله شفاف در اطراف محیط کشت نشاندهنده تولید آنزیم سلولاز در نظر گرفته شد.
بررسی تولید و سنجش فعالیت آنزیم گلوتامیناز:
برای بررسی تولید آنزیم گلوتامیناز، باکتریهای نمک دوست در محیط کشت حاوی 2 گرم Na2HPO4، 3 گرم KH2PO4، 5 گرم L-glutamin، 5/0 گرم MgSO4، 15/0 گرم CaCl2،2 گرم گلوگز و 15 گرم آگار به همراه 10 درصد NaCl بر یک لیتر آب مقطر دیونیزه اضافه گردید. پس از اتوکلاو و استریل کردن محیط و آمادهسازی در پتری دیشهای مخصوص کشت باکتریایی، باکتریها کشت داده شدند. در مرحله بعدی 5/2 سیسی محلول استوک شامل 3 درصد برموتیمول به لو در اتانول بهعنوان اندیکاتور pH ریخته شد و سپس به مدت 48 ساعت در دمای 37 درجه سانتیگراد انکوبه گردید. ایجاد تغییر رنگ اطراف کلنی نشان از تولید گلوتامیناز دارد.
بررسی تولید و سنجش فعالیت آنزیم فیتاز:
برای بررسی تولید آنزیم فیتاز محیط کشت حاوی 3 گرم (NH4)2SO4، 5/0 گرم MgSO4، 5 گرم Ca-phytate، 1/0 گرم CaCl2، 01/0 گرم MnSO4، 1/0 گرم FeSO4، 10 گرم گلوگز و 20 گرم آگار باکتریایی که در یک لیتر آب مقطر دیونیزه حل و استریل گردیده بود استفاده شد. محیطهای کشت حاوی باکتری به مدت 72 ساعت در دمای 37 درجه انکوبه شدند. وجود هاله شفاف در اطراف کلنی، نشاندهنده تولید آنزیم فیتاز بهوسیله باکتریهای نمک دوست جداسازی شده است.
بررسی تولید آنزیم و سنجش فعالیت آنزیم بتاگلوکاناز:
بهمنظور بررسی توانایی تولید آنزیم بتاگلوکاناز از محیط کشت LB Lysogeny broth حاوی 02/0 درصد لچینن (1,3:1,4-B-D-Glucan) بهعنوان سوبسترای آنزیم بتاگلوکاناز استفاده شد. محیط کشت مخصوص آنزیم بتاگلوکاناز حاوی 4 گرم عصاره مخمر، 10 گرم مالت، 3 گرم عصاره گوشت، 3/0 گرم MgSO4، 5/0 گرم CaCl2، 1 گرم K2HPO4 در یک لیتر آب مقطر دیونیزه میباشد. محیط کشتهای حاصل به مدت 48 ساعت در دمای 37 درجه انکوبه شدند. وجود هاله شفاف پس از افزودن معرف کنگورد نشاندهنده توانایی باکتری در تولید آنزیم بتاگلوکاناز است.
بررسی فعالیت کاتالیتیکی آنزیمها:
برای بهینهسازی شرایط واکنش، ابتدا واکنش آنزیمی در pH های مختلف اسیدی و بازی شامل 4، 5، 6، 7، 8، 9 و 10 موردبررسی قرار گرفت. در این آزمایشها برای تنظیم pH های اسیدی از بافر محلول اسیدسیتریک 1/0 مولار و تری سدیم سیترات 1/0 مولار و جهت تنظیم 7=pH از بافر فسفات 1/0 مولار و برای تنظیم pH های قلیایی از بافرتریس 1/0 مولار استفاده گردید.
بهمنظور بررسی دما 250 میکرولیتر از باکتریهای نمک دوست در 5 لوله آزمایش ریخته شد و به هرکدام از لولهها 500 میکرولیتر از بافر با pH بهینهشده و 1 سیسی از محلول بتاگلوکان 1 درصد اضافه شد. سپس لولهها به در دماهای 30، 40،50،60،70 درجه در انکوباتور به مدت یک ساعت گذاشته شدند. بعد از یک ساعت لولهها از انکوباتور برداشته شدند و به هر لوله 1 سیسی دی-نیتروسالیسیلیک اسید اضافه گردید و به مدت 5 دقیقه در حمام آب جوش قرار داده شدند. درنهایت جذب آنها در طولموج 540 نانومتر خوانده شد.
استخراج DNA و تکثیر قطعه 16S rRNA باکتریها با استفاده از PCR:
استخراج DNA باکتریها با استفاده از کیت استخراج DNA کیاژن انجام گرفت. واکنش زنجیرهای پلیمراز با حجم نهایی 25 میکرولیتر حاوی 10 نانوگرم بر میکرولیتر DNA، 4/0 میلی مولار dNTP، 2 میلی مولار کلرید منیزیم، 5/2 میکرولیتر بافر PCR و 1 واحد آنزیم Taq DNA Polymerase انجام گردید. واکنش PCR با روش استاندارد و با استفاده از پرایمرهای عمومی (F: 5’-AGAGTTTGATCCTGGCTCAG-3’, R: 5’-GACGGGCGGTGTGTACAA-3’) در دستگاه ترمال سایکلر (Eppendorf, Germany) تحت شرایط دمایی 5 دقیقه واسرشت شدن اولیه در دمای 94 درجه سانتیگراد و ادامه 40 چرخه شامل واسرشت در دمای 94 درجه سانتیگراد به مدت 1 دقیقه، اتصال در دمای 45 درجه سانتیگراد به مدت 30 ثانیه، طویل شدن در دمای 72 درجه سانتیگراد به مدت 90 ثانیه و درنهایت طویل شدن نهایی در دمای 72 درجه سانتیگراد به مدت 5 دقیقه انجام گرفت (16). درنهایت، قطعه تکثیر شده جهت تعیین توالی به شرکت تکاپوزیست ارسال گردید. ژنهای توالی یابی شده با 16SrRNA مرجع موجود در NCBI مقابسه شد.
یافتهها
جداسازی و شناسایی باکتریهای تولیدکننده آنزیمهای فیتاز، گلوکاناز، سلولاز و گلوتامیناز:
مطالعه حاضرجهت بررسی توانایی تولید آنزیمهایی هیدرولایتیک بر روی باکتریهای نمک دوست موردنظر انجام شد. از مجموع هفت باکتری جدا شده از خاک مرکزی ایران، تعدادی از باکتریهای نمک دوست برای تولید آنزیمهای گلوکاناز، سلولاز و گلوتامیناز مثبت بودند. این جدایهها بر اساس نتایج حاصل از تکثیر قطعه S rDNA 16 در اندازهای تقریبی 1500 جفت باز، با استفاده از تعیین توالی و بلاست انفورماتیکی در پایگاههای ژن جهانی (https://www.ncbi.nlm.nih.gov) شناسایی گردیدند. نتایج به دست آمده مربوط به جنس و گونه باکتریهای جداسازی شده در جدول 1 آورده شدهاند.
جدول (1): نتایج توانایی تولید آنزیمهای هیدرولایتیک بهوسیله باکتریهای نمک دوست جداسازی شده
| فیتاز | سلولاز | گلوکاناز | گلوتامیناز | گونه باکتری | ایزوله |
| - | + | + | + | Bacillus subtillis | D6A |
| - | - | + | - | Bacillus subtillis | DAR |
| - | - | - | - | Halobacillus trueperi | 6(2)A |
| - | - | - | - | Virgibacillus halodentrificans | 1NB |
| - | - | - | - | Virgibacillus halodentrificans | 2NB |
| - | - | - | - | Bacillus hwajinpoensis | 3NB |
| - | - | - | - | Virgibacillus olivae | D8B |
جداسازی باکتریهای تولیدکننده آنزیم فیتاز:
پس از 48 ساعت انکوباسیون باکتری در محیط کشت مخصوص آنزیم فیتاز، هیچکدام از 20 باکتری جداشده از خاک توانایی تولید آنزیم فیتازو ایجاد هاله شفاف را نداشند.
جداسازی باکتریهای تولیدکننده آنزیم گلوکاناز:
پس از 48 ساعت انکوباسیون در محیط کشت تولید آنزیم گلوکاناز و اضافه نمودن محلول کنگورد برروی محل کشت باکتری، 2 باکتری از مجموع 20 باکتری نمک دوست جدا شده، مثبت گزارش شد. باکتریهای نمک دوست تولیدکننده آنزیم گلوکاناز، متعلق به جنس و گونه Bacillus subtillis بودند.
جداسازی باکتریهای تولیدکننده آنزیم سلولاز:
پس از 48 ساعت انکوباسیون در دمای 30 درجه در محیط کشت تولید آنزیم سلولاز و اضافه نمودن محلول کنگورد برروی محل کشت باکتری و شستشو با کلرید سدیم یک مولار، 1 باکتری از مجموع 20 باکتری نمک دوست جدا شده نتیجه مثبت نشان داد. این باکتری نمک دوست تولیدکننده آنزیم سلولاز، متعلق به جنس
و گونه Bacillus subtillis بود.
جداسازی باکتریهای تولیدکننده آنزیم گلوتامیناز:
پس از 48 ساعت انکوباسیون، در محیط کشت تولید آنزیم گلوتامیناز تغییر رنگ اطراف کلنیهای باکتریهای مورد آزمایش به دقت بررسی گردید و تنها در یک باکتری از مجموع 20 باکتری نمک دوست جدا شده، نتیجه مثبت گزارش شد. باکتری نمک دوست تولیدکننده آنزیم گلوتامیناز متعلق به جنس و گونه Bacillus subtillis بود.
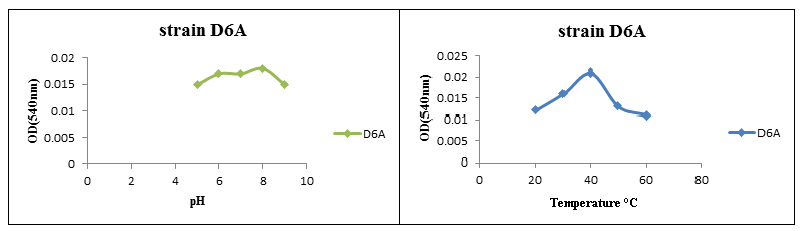
تأثیر pH و دما بر فعالیت آنزیم سلولاز:
تأثیر pH بر عملکرد آنزیم سلولاز موردبررسی قرار گرفت و سپس میزان جذب نوری در طولموج nm 540 اندازه گیری شد. نتایج نشان داد pH بهینه برای فعالیت آنزیم سلولاز جدا شده از باکتریهای نمک دوست، 8 pH است. همچنین نتایج حاصل از بررسیهای به دست آمده بر فعالیت آنزیم سلولاز جداشده از باکتریهای نمک دوست، نشان دادند که بهترین دما برای فعالیت آنزیم سلولاز در سویه جداشده 40 درجه سانتیگراد است.
پس از 48 ساعت انکوباسیون باکتری در محیط کشت مخصوص آنزیم فیتاز، هیچکدام از 20 باکتری جداشده از خاک توانایی تولید آنزیم فیتازو ایجاد هاله شفاف را نداشند.
جداسازی باکتریهای تولیدکننده آنزیم گلوکاناز:
پس از 48 ساعت انکوباسیون در محیط کشت تولید آنزیم گلوکاناز و اضافه نمودن محلول کنگورد برروی محل کشت باکتری، 2 باکتری از مجموع 20 باکتری نمک دوست جدا شده، مثبت گزارش شد. باکتریهای نمک دوست تولیدکننده آنزیم گلوکاناز، متعلق به جنس و گونه Bacillus subtillis بودند.
جداسازی باکتریهای تولیدکننده آنزیم سلولاز:
پس از 48 ساعت انکوباسیون در دمای 30 درجه در محیط کشت تولید آنزیم سلولاز و اضافه نمودن محلول کنگورد برروی محل کشت باکتری و شستشو با کلرید سدیم یک مولار، 1 باکتری از مجموع 20 باکتری نمک دوست جدا شده نتیجه مثبت نشان داد. این باکتری نمک دوست تولیدکننده آنزیم سلولاز، متعلق به جنس
و گونه Bacillus subtillis بود.
جداسازی باکتریهای تولیدکننده آنزیم گلوتامیناز:
پس از 48 ساعت انکوباسیون، در محیط کشت تولید آنزیم گلوتامیناز تغییر رنگ اطراف کلنیهای باکتریهای مورد آزمایش به دقت بررسی گردید و تنها در یک باکتری از مجموع 20 باکتری نمک دوست جدا شده، نتیجه مثبت گزارش شد. باکتری نمک دوست تولیدکننده آنزیم گلوتامیناز متعلق به جنس و گونه Bacillus subtillis بود.
تأثیر pH و دما بر فعالیت آنزیم سلولاز:
تأثیر pH بر عملکرد آنزیم سلولاز موردبررسی قرار گرفت و سپس میزان جذب نوری در طولموج nm 540 اندازه گیری شد. نتایج نشان داد pH بهینه برای فعالیت آنزیم سلولاز جدا شده از باکتریهای نمک دوست، 8 pH است. همچنین نتایج حاصل از بررسیهای به دست آمده بر فعالیت آنزیم سلولاز جداشده از باکتریهای نمک دوست، نشان دادند که بهترین دما برای فعالیت آنزیم سلولاز در سویه جداشده 40 درجه سانتیگراد است.

شکل (1): تأثیر pH و دما بر روی فعالیت آنزیم سلولاز از سویه D6A
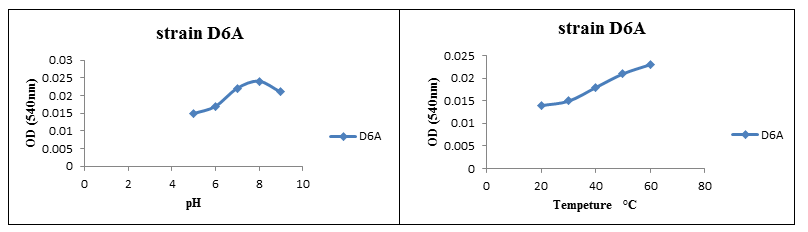
تأثیر pH و دما بر پایداری آنزیم سلولاز:
بر اساس نتایج به دست آمده از مطالعه تأثیر دما بر روی پایداری آنزیم سلولاز جداشده از باکتریهای نمک دوست، بهترین دما برای فعالیت آنزیم سلولاز در سویه جداشده 60 درجه سانتیگراد بود. همچنین pH بهینه بر روی پایداری آنزیم مذکور، 8 pH به دست آمد.
بر اساس نتایج به دست آمده از مطالعه تأثیر دما بر روی پایداری آنزیم سلولاز جداشده از باکتریهای نمک دوست، بهترین دما برای فعالیت آنزیم سلولاز در سویه جداشده 60 درجه سانتیگراد بود. همچنین pH بهینه بر روی پایداری آنزیم مذکور، 8 pH به دست آمد.

شکل (2): تأثیر pH و دما بر روی پایداری آنزیم سلولاز از سویه D6A
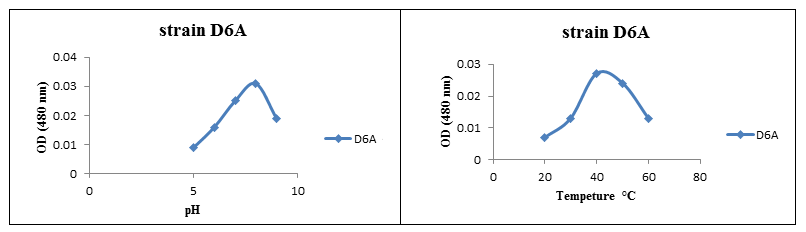
تأثیر pH و دما بر فعالیت آنزیم گلوتامیناز:
تأثیر pH بر عملکرد آنزیم گلوتامیناز موردبررسی قرار گرفت و سپس میزان جذب نوری در طولموج nm 480 اندازه گیری شد. نتایج نشان داد pH بهینه برای فعالیت آنزیم گلوتامیناز جدا شده از باکتریهای نمک دوست، 8 pH است. همچنین بر اساس نتایج به دست آمده، بهترین دما برای فعالیت آنزیم سلولاز در سویه جداشده، 40 درجه سانتیگراد در نظر گرفته شد.

شکل (3): تأثیر pH و دما بر روی فعالیت آنزیم گلوتامیناز از سویه D6A
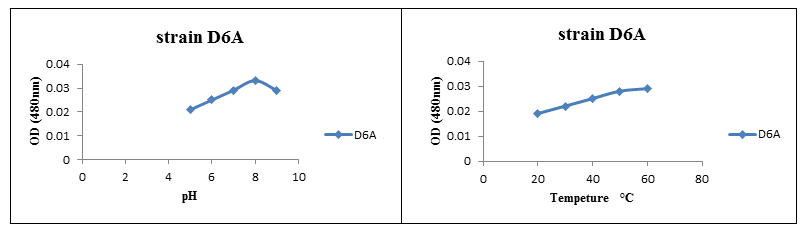
تأثیر pH و دما برروی پایداری آنزیم گلوتامیناز:
تأثیر pH و دما بر روی پایداری آنزیم گلوتامیناز جداشده از باکتریهای نمک دوست موردبررسی قرار گرفت نتایج حاصله نشان داد که pH بهینه برای فعالیت آنزیم گلوتامیناز در سویه جداشده، 8 pH و دمای بهینه برای فعالیت آنزیم گلوتامیناز در سویه جداشده، 60 درجه سانتیگراد بود.
تأثیر pH و دما بر روی پایداری آنزیم گلوتامیناز جداشده از باکتریهای نمک دوست موردبررسی قرار گرفت نتایج حاصله نشان داد که pH بهینه برای فعالیت آنزیم گلوتامیناز در سویه جداشده، 8 pH و دمای بهینه برای فعالیت آنزیم گلوتامیناز در سویه جداشده، 60 درجه سانتیگراد بود.

شکل (4): تأثیر pH و دما بر روی پایداری آنزیم گلوتامیناز از سویه D6A
تأثیر pH و دما بر فعالیت آنزیم بتاگلوکاناز:
بر طبق نتایج حاصله، دو سویه جداشده از باکتریهای نمک دوست، شامل سویه D6A و سویه Dar قابلیت تولید آنزیم بتاگلوکاناز را نشان دادند. در بررسی تأثیر pH بر عملکرد آنزیم بتاگلوکاناز بر روی این دو سویه، مشخص گردید که pH بهینه برای فعالیت آنزیم بتاگلوکاناز در سویه D6A، 9pH و بهترین دما برای فعالیت این آنزیم 50 درجه سانتیگراد میباشد. نتایج برای سویه Dar نیز مشابه با سویه قبلی گزارش گردید، بدین ترتیب که pH بهینه برابر با 9 pH و دمای بهینه 50 درجه سانتیگراد ثبت گردید.


شکل (5): تأثیر pH و دما بر فعالیت آنزیم بتاگلوکاناز در سویه D6A
شکل (6): تأثیر pH و دما بر فعالیت آنزیم بتاگلوکاناز در سویه Dar
مناطق نمکی و فوق اشباع از نمک در سراسر کره زمین، همچون دریاچههای نمک و یا معادن نمک وجود دارند. این مناطق نمکی شرایط بسیار سخت برای زیستن موجودات عادی فراهم میکنند. این در حالیست که تعدادی از میکروارگانیسمها شامل گروهی از باکتریها و آرکی باکتریها، قابلیت زیستن در این شرایط دشوار را دارند. آنزیمهای هیدرولایتیک تولید شده توسط این میکروارگانیسمها خصوصیات منحصر به فردی شامل مقاومت به شوری، دما و غیره را از خود نشان میدهند (17).
آنزیمهای هیدرولایتیک ازجمله ترکیبات مهم در صنعت داروسازی و پزشکی به شمار میروند که در سالهای اخیر تولیدات میکروبی آنها بسیار مورد توجه قرار گرفته است. در حال حاضر تولید 80 درصد کل آنزیمهای مورد استفاده در این صنعت به کمک میکروارگانیسمها صورت میگیرد. مشخص گردیده است که اکثر آنزیمهای تولید شده توسط میکروارگانیسمها کاربردیتر از آنزیمهای مشتق شده توسط گیاهان و حیوانات میباشند که این امر میتواند به علت تنوع فعالیت کاتالیکی، بازده بالا، سهولت در دستکاری ژنتیکی، فراورده منظم و رشد سریع میکروارگانیسم در محیطهای کم هزینه باشد (18, 19).
فرایندهای صنعتی معمولاً تحت شرایط فیزیکی و شیمیایی انجام میشوند که برای فعالیت آنزیمهای صنعتی مطلوب و بهینه نیستند، به همین دلیل آنزیمهایی که بتوانند بهینه فعالیت خود را در شرایط دشوار ازنظر دما و نمک نشان دهند، ازاهمیت بسیار بالایی برخوردار میباشند. باکتریهای نمک دوست منبع چنین آنزیمهایی هستند، در حقیقت آنزیمهای به دست آمده از این میکروارگانیسمها، نه تنها غلظت بالای نمک را تحمل میکنند، بلکه بسیاری از آنها نسبت به حرارت نیز متحملتر میباشند. شناسایی باکتریهای نمک دوستی که توانایی ویژهای در تولید آنزیمهای خارج سلولی دارند، این امکان را فراهم میکند که بتوان آنزیمهایی به دست آورد که فعالیت بهینه در غلظتهای مختلف نمک و دماهای بالا داشته باشند (20). ازجمله آنزیمهای هیدرولایتیک مهم که باکتریهای نمک دوست توانایی تولید آنها را دارند آنزیم بتاگلوکاناز است که کاربرد گستردهای در کاغذ سازی، صنایع غذایی و صنایع خوراکی و دارویی دارد (21).
در این تحقیق باکتریهای نمک دوست از خاک نمکی بیابانهای فلات مرکزی ایران جداسازی شد و تولید آنزیمهای فیتاز، سلولاز، گلوتامیناز و بتاگلوکاناز بر روی آنها بررسی شد، سپس تأثیر دما و pH روی این آنزیمها مورد ارزیابی قرار گرفت.
نتایج حاصل از پژوهش انجام شده، نشان داد که هیچکدام از سویههای جدا شده از باکتریهای نمک دوست، توانایی تولید آنزیم فیتاز را ندارند. این در حالیست که چندین سویه قادر به تولید آنزیمهای سلولاز، گلوتامیناز و بتاگلوکاناز بودند.
بررسی فعالیت کاتالیتیکی آنزیم بتاگلوکاناز تولید شده بهوسیله باکتری Bacillus subtilis، کلونینگ ژن تولیدکننده β-1,3-1,4-glucanase از باکتری Bacillus licheniformis (CGMCC 0635)، بررسی خصوصیات آنزیم بتاگلوکوناز بهوسیله باکتری Bacillus subtilis (GN156) و تولید آنزیم بتاگلوکاناز بهوسیله Bacillus halodurans C-125 ازجمله پژوهشهایی است که بر روی میکروارگانیسمهای تولیدکننده آنزیم بتاگلوکاناز انجام گردیده است. در پژوهشی که در باکتریهای نمک دوست نسبی Bacillus sp. L1 از منطقه Yuncheng کشور چین جداسازی شده بود، این باکتری توانایی تولید آنزیم سلولاز را داشت. آنزیم سلولاز تولید شده بهترین pH برای فعالیت این آنزیم 8 و بهترین دمای فعالیت 60 درجه سانتیگراد به دست آمد و همچنین بهترین دمای پایداری آن در 80-30 درجه سانتیگراد و بهترین pH برای پایداری آنزیم 9-7 بود (22). در پژوهشی که بر روی باکتریهای نمک دوست Gracilibacillus sp. SK1 جدا شده از خاک دریاچه Yuncheng انجام شد، باکتریهای نمکدوست جداسازی شده توانایی تولید آنزیم سلولاز مقاوم به شرایط قلیایی را داشتند. بهترین pH برای فعالیت آنزیم سلولاز تولید شده بهوسیله این باکتری 8 و بهترین دمای فعالیتش 60 درجه سانتیگراد بود. این آنزیم در رنج دمایی 70-40 درجه سانتیگراد و pH 10-6 پایدار بود (23).
در پژوهشی که باکتری تولیدکننده آنزیم گلوتامیناز از Gangotri Region جداسازی شده بود، بهترین pH برای فعالیت آنزیم جداسازی شده 11 و بهترین دمای فعالیت 70 بود. همچنین بهتری pH پایداری آنزیم 11-8 و بهتری دمای پایداری آن 50 درجه سانتیگراد بود. باکتری جداسازی شده متعلق به خانواده Bacillus بود (24). در پژوهشی باکتری Lactobacillus rhamnosus توانایی تولید آنزیم گلوتامیناز داشت که این آنزیم مقاوم به شرایط نمکی و دما بود. بهترین pH برای فعالیت آنزیم گلوتامیناز جداسازی شده 7 و بهترین دمای فعالیت 50 درجه سانتیگراد بود (25). در پژوهش حاضر باکتری نمکدوست تولیدکننده آنزیم گلوتامیناز متعلق به خانواده Bacillus بود که بهترین pH برای فعالیت آنزیم گلوتامیناز تولید شده بهوسیله این باکتری 8 و بهترین دمای فعالیتش 50 درجه سانتیگراد بود و همچنین بهترین دمای پایداری آن در 60 درجه سانتیگراد و بهترین pH برای پایداری آنزیم 8 بود. در پژوهش حاضر باکتری نمکدوست تولیدکننده آنزیم گلوتامیناز متعلق به خانواده Bacillus بود که بهترین pH برای فعالیت آنزیم گلوتامیناز تولید شده بهوسیله این باکتری 8 و بهترین دمای فعالیتش 50 درجه سانتیگراد بود و همچنین بهترین دمای پایداری آن در 60 درجه سانتیگراد و بهترین pH برای پایداری آنزیم 8 بود.
در پژوهشی که بهوسیله شعله ده پهلوان و همکارانش در سال 1395 انجام شد، باکتری باسیلوس سوبتلیس B5d از فیلوسفر باغات سیب استان کرمان جداسازی شد که تولید آنزیم بتاگلوکوناز بهوسیله آن در سال 1395 بررسی شد. در این پژوهش نشان داده که بیشترین فعالیت کاتالیتیکی آنزیم بتاگلوکوناز در دمای 50 درجه سانتیگراد و بهترین pH برای آن 6 بوده است (26).
در پژوهشی که توسط Gilvan Pessoa Furtado و همکارانش در سال 2011 بر روی باکتری Bacillus subtilis 168 انجام شد نشان داد که بهترین فعالیت کاتالیتیکی آنزیم بتاگلوکوناز در دمای 50 درجه سانتیگراد و بهترین pH فعالیت کاتالیتیکی آن 6 است (27). در پژوهشی که بهوسیله Da Teng و همکارانش در سال 2006 بر روی تولید آنزیم β-1,3-1,4-glucanase از Bacillus licheniformis EGW039 (CGMCC 0635) انجام شد، که نتایج بهترین دمای فعالیت کاتالیتیکی آنزیم β-1,3-1,4-glucanase 40 درجه سانتیگراد و بهتری pH برای فعالیت کاتالیتیکی این آنزیم 6/5 بود (28). در پژوهشی که در سال 2006 بر روی باکتری Bacillus subtilis GN156 بهوسیله Jirawan Apiraksakorn و همکارانش فعالیت کاتالیتیکی آنزیم β-1,3-1,4-glucanase بررسی شده نشان داد بهترین دمای فعالیت کاتالیتیکی آنزیم β-1,3-1,4-glucanase 65 درجه سانتیگراد و بهتری pH برای فعالیت کاتالیتیکی این آنزیم 7 بود (29). در پژوهش پنجم Masatake Akita و همکارانش در سال 2005 بر روی باکتری Bacillus halodurans C-125 نشان داده شد که این باکتری که توانایی تولید آنزیم بتاگلوکوناز دارد، بهترین دمای فعالیت کاتالیتیکی آن 60 درجه سانتیگراد و بهترین pH 6 بود (30).
این نتایج نشان داد که آنزیم بتاگلوکاناز تولید شده بهوسیله باکتریهای نمک دوست جداسازی شده، بهترین فعالیت کاتالیتیکی خود را در pH قلیایی نشان میدهند که میتواند بسیار ارزشمند باشد زیرا در شرایط سخت، آنزیم بتاگلوکاناز توانایی انجام دادن بهترین عملکردش را دارد. بی تردید خاک منبع مهمی جهت جداسازی میکروارگانیسمهای تولیدکننده آنزیمهای صنعتی است. کشور ما با توجه به تنوع اقلیمی، دارای منابع بسیار غنی است. با جداسازی و شناسایی سویههای بومی برتر تولیدکننده آنزیمهای صنعتی و اعمال روشهای مهندسی زیستی، میتوان جهت بومی سازی و بهینهسازی این آنزیمها گام موثری در صنایع داروسازی و پزشکی برداشت. در این مطالعه گونههای مختلف بومی ایران معرفی شدند. کاملاً محرز است که بررسی و شناسایی باکتریهای بومی خصوصاً در مناطق دست نیافتنی و بکر، بهعنوان ذخایر ژنتیکی کشور و ثروت ملی سرزمینمان، بسیار حائز اهمیت خواهد بود.
نتیجهگیری
نتایج حاصل از تحقیق مشخص کرد که باکتریهای نمک دوست جداسازی شده از خاک بیابانهای نمکی مرکز ایران توانایی تولید آنزیمهای هیدرولایتیک همچون گلوتامیناز، سلولاز و بتاگلوکاناز را دارند و میتوانند منبع مناسبی جهت تولید آنزیمهایی با خواص منحصر به فرد مانند، مقاومت به شوری باشند که برای کارهای صنعتی و پژوهشی خصوصاً داروسازی صنعتی مورد استفاده قرار گیرند. بنابراین تحقیقات بیشتر جهت دستیابی به شرایط بهینه تولید و تجاری سازی این آنزیمها توسط جدایههای مذکور، موردنیاز بوده و توصیه میگردد.
تشکر و قدردانی
این مقاله مستخرج از پایانامه های دکتری عمومی دانشکده داروسازی دانشگاه علوم پزشکی تبریز با شماره پایاننامه های 4023، 4018 است.
ملاحظات اخلاقی
با توجه به اینکه این مطالعه بر روی نمونههای جانوری یا انسانی انجام نیافته است، لذا ملاحظات اخلاقی مربوطه در این پژوهش موضوعیت ندارد.
منابع مالی
این پژوهش با هزینه مالی نویسنده مسئول انجام یافته است.
منابع متقابل
مؤلف اظهار میدارد که منافع متقابلی از تألیف یا انتشار این مقاله ندارد.
مشارکت مولفان
همکاران اجرا و تحلیل نتایج مطالعه را برعهده داشتند. آ.د همچنین مقاله را تألیف نموده و نسخه نهایی آن را مطالعه و تأیید نموده است.
نوع مطالعه: پژوهشي(توصیفی- تحلیلی) |
موضوع مقاله:
میکروبیولوژی
فهرست منابع
1. Amziane M, Darenfed-Bouanane A, Abderrahmani A, Selama O, Jouadi L, Cayol J-L, et al. Virgibacillus ainsalahensis sp. nov., a Moderately Halophilic Bacterium Isolated from Sediment of a Saline Lake in South of Algeria. Curr Microb 2017;74(2):219-23. [DOI:10.1007/s00284-016-1171-0] [PMID]
2. Kushner D. Halophilic bacteria. Adv Appl Microbiol 1968;10:73-99.
https://doi.org/10.1016/S0065-2164(08)70189-8 [DOI:10.1016/s0065-2164(08)70189-8] [PMID]
3. Vahed SZ, Forouhandeh H, Tarhriz V, Chaparzadeh N, Hejazi MA, Jeon CO, et al. Halomonas tabrizica sp. nov., a novel moderately halophilic bacterium isolated from Urmia Lake in Iran. Antonie Van Leeuwenhoek 2018;111:1139-48. [DOI:10.1007/s10482-018-1018-8] [PMID]
4. Priyodip P, Prakash PY, Balaji S. Phytases of probiotic bacteria: characteristics and beneficial aspects. Indian J Microbiol 2017;57(2):148-54. [DOI:10.1007/s12088-017-0647-3] [PMID] [PMCID]
5. Khan SA, Zununi Vahed S, Forouhandeh H, Tarhriz V, Chaparzadeh N, Hejazi MA, et al. Halomonas urmiana sp. nov., a moderately halophilic bacterium isolated from Urmia Lake in Iran. Int J Syst Evol Microbiol 2020;70(4):2254-60. [DOI:10.1099/ijsem.0.004005] [PMID]
6. Almeida FN, Sulabo RC, Stein HH. Effects of a novel bacterial phytase expressed in Aspergillus oryzae on digestibility of calcium and phosphorus in diets fed to weanling or growing pigs. J Animal Sci Biotech 2013;4(1):1-10. [DOI:10.1186/2049-1891-4-8] [PMID] [PMCID]
7. Shen L, Wu X-Q, Zeng Q-W, Liu H-B. Regulation of soluble phosphate on the ability of phytate mineralization and β-propeller phytase gene expression of Pseudomonas fluorescens JZ-DZ1, a phytate-mineralizing rhizobacterium. Curr Microbiol 2016;73(6):915-23. [DOI:10.1007/s00284-016-1139-0] [PMID]
8. Klemm R, Wyzga R, Thomas E. Daily Mortality and Air Pollution in Atlanta: August 1998-December 2006. Epidemiology 2009;20(6):S223. [DOI:10.1097/01.ede.0000362748.64100.18]
9. Lambertz C, Garvey M, Klinger J, Heesel D, Klose H, Fischer R, et al. Challenges and advances in the heterologous expression of cellulolytic enzymes: a review. Biotech Biofuel 2014;7(1):1-15. [DOI:10.1186/s13068-014-0135-5] [PMID] [PMCID]
10. Vuong TV, Franco C, Zhang W. Treatment strategies for high resveratrol induction in Vitis vinifera L. cell suspension culture. Biotech Rep 2014;1:15-21. [DOI:10.1016/j.btre.2014.04.002] [PMID] [PMCID]
11. Muthu Narayanan M, Ahmad N, Shivanand P, Metali F. The Role of Endophytes in Combating Fungal-and Bacterial-Induced Stress in Plants. Molecules 2022;27(19):6549. [DOI:10.3390/molecules27196549] [PMID] [PMCID]
12. Ariffin H, Abdullah N, Umi Kalsom M, Shirai Y, Hassan M. Production and characterization of cellulase by Bacillus pumilus EB3. Int J Eng Technol 2006;3(1):47-53. [URL]
13. Gupta P, Sharma S, Saxena S. Biomass yield and steviol glycoside production in callus and suspension culture of Stevia rebaudiana treated with proline and polyethylene glycol. Appl Biochem biotech 2015;176(3):863-74. [DOI:10.1007/s12010-015-1616-0] [PMID]
14. Binod P, Sindhu R, Madhavan A, Abraham A, Mathew AK, Beevi US, et al. Recent developments in l-glutaminase production and applications-An overview. Bioresour Techn 2017;245:1766-74. [DOI:10.1016/j.biortech.2017.05.059] [PMID]
15. Garabito MJ, Arahal DR, Mellado E, Márquez MC, Ventosa A. Bacillus salexigens sp. nov., a new moderately halophilic Bacillus species. Int J System Evol Microbiol 1997;47(3):735-41. [DOI:10.1099/00207713-47-3-735] [PMID]
16. Tarhriz V, Nouioui I, Spröer C, Verbarg S, Ebrahimi V, Cortés-Albayay C, et al. Pseudomonas khazarica sp. nov., a polycyclic aromatic hydrocarbon-degrading bacterium isolated from Khazar Sea sediments. Antonie Van Leeuwenhoek 2020;113(4):521-32. [DOI:10.1007/s10482-019-01361-w] [PMID]
17. Enache M, Kamekura M. Hydrolytic enzymes of halophilic microorganisms and their economic values. Rom J Biochem 2010;47:47-59. [Google Scholar]
18. Kazemi E, Tarhriz V, Hejazi MS, Amoozegar MA. Isolation and Characterization of Halophilic and Halotolerant Bacteria from Urmia Lake after the Recent Drought Disaster in 2015. Curr Biotech 2020;9(2):111-9. [DOI:10.2174/2211550109999200802153647]
19. Kazemi E, Tarhriz V, Amoozegar MA, Hejazi MS. Halomonas azerbaijanica sp. nov., a halophilic bacterium isolated from Urmia Lake after the 2015 drought. Int J System Evol Microbiol 2021;71(1):004578. [DOI:10.1099/ijsem.0.004578] [PMID]
20. de Lourdes Moreno M, Pérez D, García MT, Mellado E. Halophilic bacteria as a source of novel hydrolytic enzymes. Life 2013;3(1):38-51. [DOI:10.3390/life3010038] [PMID] [PMCID]
21. Malik AD, Furtado IJ. 8 Pretreatment and. Enzymes in the Valorization of Waste: Enzymatic Pretreatment of Waste for Development of Enzyme-based Biorefinery. Mazandaran Univ Med Sci 2022:187. [DOI:10.1201/9781003187714-8] [PMID]
22. Li X, Yu H-Y. Purification and characterization of an organic-solvent-tolerant cellulase from a halotolerant isolate, Bacillus sp. L1. J Industrial Microbiol Biotechnol 2012;39(8):1117-24. [DOI:10.1007/s10295-012-1120-2] [PMID]
23. Yu H-Y, Li X. Alkali-stable cellulase from a halophilic isolate, Gracilibacillus sp. SK1 and its application in lignocellulosic saccharification for ethanol production. Biomass Bioenergy 2015;81:19-25. [DOI:10.1016/j.biombioe.2015.05.020]
24. Kumar S, Karan R, Kapoor S, Singh S, Khare S. Screening and isolation of halophilic bacteria producing industrially important enzymes. Brazil J Microbiol 2012;43:1595-603.
https://doi.org/10.1590/S1517-83822012000400044 [DOI:10.1590/s1517-83822012000400044] [PMID] [PMCID]
25. Weingand-Ziadé A, Gerber-Décombaz C, Affolter M. Functional characterization of a salt-and thermotolerant glutaminase from Lactobacillus rhamnosus. Enzyme and Microbial Technology. 2003;32(7):862-7.
https://doi.org/10.1016/S0141-0229(03)00059-0 [DOI:10.1016/s0141-0229(03)00059-0]
26. Dahpahlevan S, Khara J, Mousivand M, Hashemi M. Determination and modeling the optimum conditions of beta glucanase Bacillus subtilis B5d activity with potential used as feed additive. Biologic J Microorg 2016;5(17):1-14. [Google Scholar]
27. Furtado GP, Ribeiro LF, Santos CR, Tonoli CC, De Souza AR, Oliveira RR, et al. Biochemical and structural characterization of a β-1, 3-1, 4-glucanase from Bacillus subtilis 168. Process Biochem 2011;46(5):1202-6. [DOI:10.1016/j.procbio.2011.01.037]
28. Teng D, Wang J-h, Fan Y, Yang Y-l, Tian Z-g, Luo J, et al. Cloning of β-1, 3-1, 4-glucanase gene from Bacillus licheniformis EGW039 (CGMCC 0635) and its expression in Escherichia coli BL21 (DE3). Appl Microbiol Biotech 2006;72(4):705-12. [DOI:10.1007/s00253-006-0329-2] [PMID]
29. Apiraksakorn J, Nitisinprasert S, Levin RE. Grass degrading β-1, 3-1, 4-D-glucanases from Bacillus subtilis GN156: purification and characterization of glucanase J1 and pJ2 possessing extremely acidic pI. Appl Biochem Biotechnol 2008;149(1):53-66. [DOI:10.1007/s12010-007-8058-2] [PMID]
30. Akita M, Kayatama K, Hatada Y, Ito S, Horikoshi K. A novel β-glucanase gene from Bacillus halodurans C-125. FEMS Microbiol Lett 2005;248(1):9-15. [DOI:10.1016/j.femsle.2005.05.009] [PMID]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







