دوره 34، شماره 4 - ( 4-1402 )
جلد 34 شماره 4 صفحات 190-182 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Tanomand A, Abbasi M. PREPARATION AND EVALUATION OF PROPERTIES OF PSEUDOMONAS AERUGINOSA EXOTOXIN A CONJUGATE WITH GOLD NANOPARTICLES. Studies in Medical Sciences 2023; 34 (4) :182-190
URL: http://umj.umsu.ac.ir/article-1-5884-fa.html
URL: http://umj.umsu.ac.ir/article-1-5884-fa.html
تنومند اصغر، عباسی معصومه. تهیه و بررسی خواص کونژوگه اگزوتوکسین A سودوموناس آئروژینوزا با نانوذره طلا. مجله مطالعات علوم پزشکی. 1402; 34 (4) :182-190
استادیار، گروه میکروبیولوژی، واحد ملکان، دانشگاه آزاد اسلامی، ملکان، ایران (نویسنده مسئول) ، masomeabasi55@yahoo.com
متن کامل [PDF 864 kb]
(1797 دریافت)
| چکیده (HTML) (3219 مشاهده)

شکل (1): الکتروفورز اگزوتوکسین A در رنگ آمیزی با نیترات نقره بر روی ژل آگارز.
نتایج تهیه اگزوتوکسین A نوترکیب:
محصول تکثیر اولیه ژن EXOA سودوموناس آئروژینوزا توسط PCR بر روی ژل آگاروز 1 درصد الکتروفورز گردید (شکل 2). پس از تخلیص قطعه ژنی EXOA و انتقال به وکتور PET22b و کلونینگ در میزبال اشرشیا کلی، سطح بالایی از بیان پروتئین نوترکیب به دست آمد که توسط الکتروفورز بر روی ژل پلی آکریل آمید (SDS-PAGE) لیزات سلول باکتریایی تأیید شد (شکل 3). همچنین رنگ آمیزی با کوماسی نشاندهنده بیان پروتئین 66 کیلودالتونی (KDa) با غلظت بالا بود (شکل 4).
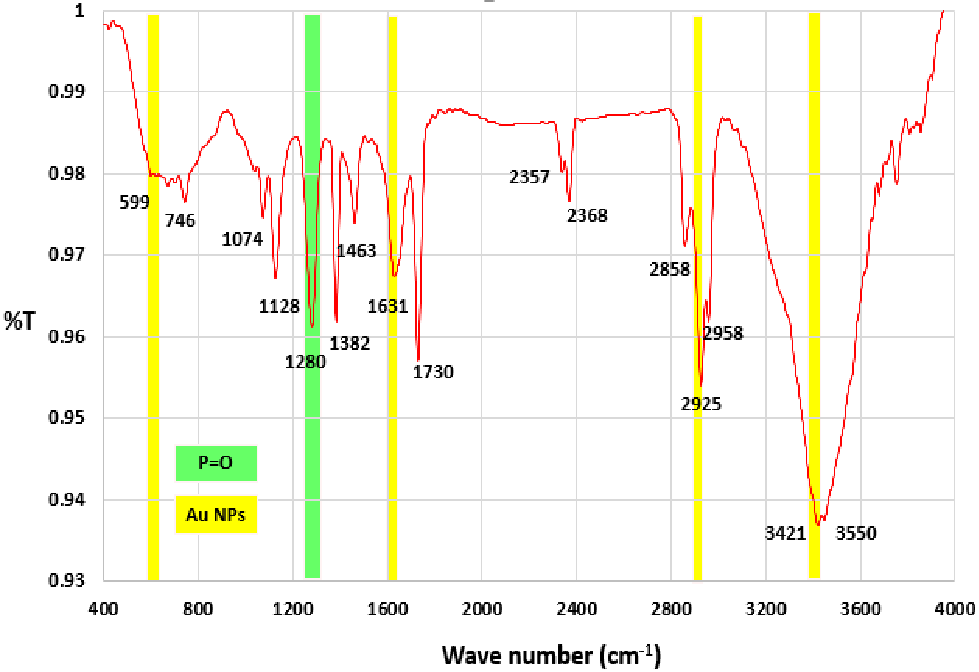
شکل (5): طیف FTIR نانو ذره طلا / اگزو توکسین A.
بحث و نتیجهگیری
سودوموناس آئروژینوز اغلب بهعنوان یک پاتوژن فرصت طلب محسوب شده و موجب ایجاد عفونتهای بیمارستانی در بیماران مبتلا به نقص سیستم ایمنی و سوختگیهای شدید میشود. یکی از فاکتورهای بیماریزا و سمی که توسط این باکتری تولید میشود اگزوتوکسین A میباشد (12). اگزوتوکسین A از طریق آندوسیتوز به سیتوپلاسم سلولی وارد شده و فاکتورهای رونویسی را غیر فعال کرده و مانع سنتز پروتئین و پاسخ ایمنی همورال میشود (13). بنابراین در مطالعه حاضر تولید و خواص خواص کونژوگه اگزوتوکسین A سودوموناس آئروژینوزا با نانوذره طلا مورد بررسی قرار گرفت.
در مطالعه حاضر از باکتری سودوموناس آئروژینوز سویه PAO1 برای تخلیص اگزوتوکسین A ذاتی استفاده شد و سپس اگزوتوکسین A نوترکیب از طریق کلون در اشرشیا کلی تهیه شد. در نهایت خواص کونژوگه اگزوتوکسین A با نانوذره طلا مورد ارزیابی قرار گرفت. نتایج به دست آمده نشان داد که اگزوتوکسین A ذاتی سودوموناس آئروژینوزا با خلوص بالا قابل استخراج است.
تخلیص اگزوتوکسین A ذاتی مشکلات بسیار و بازده پایینی داشته و تولید نوترکیب آن در مطالعات مختلف مورد توجه قرار گرفته است (14، 15). در مطالعه حاضر دمین I و II (دمین اتصال به گیرنده) کلون و تکثیر شد که یک ترکیب غیر سمی از اگزوتوکسین A میباشد. نتایج به دست آمده نشان داد که تولید اگزوتوکسین A نوترکیب در غلظت بالا امکانپذیر است. شواهد نشان میدهد این دمین اثرات سمیت اگزوتوکسین A را خنثی میکند (16، 17). بنابراین در مطالعه حاضر پس از تخلیص و تهیه اگزوتوکسین A ذاتی و نوترکیب، با نانوذرات طلا کونژوگه شدند. نتایج به دست آمده نشان داد که نانوذرات طلا با هر دو اگزوتوکسین A ذاتی و نوترکیب بهخوبی کونژوگه میشود. همچنین نتایج حاصل از موشهای ایمن شده، ایمنی بالایی با اگزوتوکسین A و نانو ذره طلا و همچنین با اگزوتوکسین A به تنهایی و نانو ذره طلا به تنهایی در مقابل تزریق داخل صفاقی نشان داد. این نتایج مشابه مطالعات Eftekharivash و همکاران (17) و Zawrah و همکاران (18) و Nazari و همکاران (19) میباشد. آنها در مطالعات خود محافظتهای معنیداری را برای گروههای موشی ایمن شده با EXOA-OprF-OprI، اما محافظت ضعیفی را برای گروههای ایمن شده با اگزو توکسین A نوترکیب گزارش کردند. بررسی مرگ موشها در گروههای مختلف ایمن شده با آنتی ژنهای مختلف نشان داد که موشهای محافظت نشده در گروههای مختلف ازجمله گروههای ایمن شده با اگزوتوکسین A در مقایسه با شاهد تلف شدند. این نتایج نشان داد ایمنی زایی با اگزوتوکسین A در ترکیب با نانو ذره طلا در خنثی کردن اثرات سمی و کشنده نقش دارد. در مطالعه مشابهی Cryz و همکاران نشان دادند که اگزوتوکسین A کونژوگه شده با زنجیره O از LPS سودوموناس آئروژینوزا یک ترکیب ایمنی زا غیر توکسیک و غیر تب زا است (20)
نانوذرات طلا با اندازه 10 نانومتر به شکل کروی بهعنوان عامل ضد باکتریایی مؤثر برای درمان عفونتهای ناشی از باکتریهای مختلف مورد بررسی قرار گرفته است. از مهمترین ویژگیهای نانوذرات طلا، اندازه بسیار کوچک با فضای سطحی بزرگ است که باعت افزایش فعالیتهای شیمیایی و بیولوژیکی انحلال پذیری و تحرک بسیار زیاد در بدن انسان و توانایی نفوذ به غشاء سلولی و خاصیت ضد باکتریایی و ضد سرطانی است (21). شواهد نشان میدهد که نانوذرات طلا با اتصال به میکروارگانیسمها موجب آسیب به غشاء سیتوپلاسمی و آسیب به فلاژلها میشود (22). همچنین نانوذرات طلا دارای ویژگیهای مطلوب دیگری نیز هستند که آنها را بهعنوان اهداف عالی برای استفاده در برنامههای تحویل دارو مطرح میسازد. هسته طلا بهطور ذاتی بی اثر، غیر سمی و سازگار با محیط زیست است و این امر نقطه شروع ایدهآل برای ساخت حاملهای دارویی میباشد. علاوه بر این نانوذرات طلا را میتوان با اندازههای مختلف (1 تا 15 نانومتر) و ابعاد متناسب با پروتئینها و دیگر مولکولهای آلی به راحتی تولید کرد (23، 24).
پژوهشهای مختلف مکانیسمهای ضد باکتریایی نانوذرات طلا را توضیح دادهاند؛ نانوذرات طلا پیوند محکمی با غشاء خارجی باکتری برقرار میکند و مانع فعالیتهای سلولی ازجمله انتقال فعال، فعالیتهای آنزیمی پری پلاسمیک و دهیدروژناز شده و در نهایت از سنتز DNA و RNA و پروتئین جلوگیری کرده و موجب لیز سلولی میشوند (25، 26). همچنین نشان داده شده است که نانوذرات طلا میتوانند آنتیبیوتیکها را به دور از آنزیمهای دفاعی باکتریایی، به هدف و گیرنده خود برسانند (27). در یک مطالعه مشابه توسط Nazari و همکاران اثرات نانوذرات طلا بر روی سودوموناس آئروژینوزا مقاوم به آنتیبیوتیک مورد بررسی قرار دادند. نتایج آنها نشان داد که نانوذرات طلا به شکل پایدار با آنتیبیوتیک کونژوگه شده و اثرات ضد میکروبی آنتیبیوتیکها را ارتقاء میدهند (19).
بهطور کلی مطالعه حاضر نشان داد که نانوذرات طلا قابلیت کونژوگاسیون با اگزوتوکسین را داشته و میتواند بهعنوان ادجوانت در تهیه واکسن اگزوتوکسین در عفونتهای بیمارستانی مورد توجه قرار گیرد. با توجه به این نتایج، استفاده از نانوذرات طلا کونژوگه با پروتئینهای باکتریایی میتواند بهعنوان یک استراتژی بالقوه برای تولید واکسنهای میکروبی در نظر گرفته شود. همچنین ممکن است این قابلیت در تشخیص بیماریهای عفونی برای توسعه دستگاههای تشخیصی مفید باشد.
تشکر و قدردانی
این مطالعه مستخرج از پایان نامه دکتری معصومه عباسی میباشد. نویسندگان از همه اعضای آزمایشگاه میکروبیولوژی دانشگاه علوم پزشکی مراغه جهت همکاری در این مطالعه قدردانی مینمایند.
متن کامل: (1167 مشاهده)
مقدمه
سودوموناس آئروژینوزا یک باکتری گرم منفی و پاتوژن فرصت طلبی است که عموماً موجب ایجاد عفونت بیمارستانی شده و به سیستم ایمنی آسیب میرساند. سودوموناس آئروژینوزا همراه با چند عامل عفونت دیگر، در بیماران با سوختگی و سیستیک فیبروزیس که داروهای تضعیف کننده سیستم ایمنی را دریافت میکند، بروز میکند (1). این باکتری بهطور متداول از زخمهای بزاق یا خلط، خون و دیگر نمونههای کلینیکی و از عفونتهای بیمارستانی جدا شده است. سپتی سمی سودوموناس آئروژینوزا بخصوص در بیماران دچار سوختگی مرگومیر بالایی دارد. فاکتورهای ویرولانس مختلفی در پاتوژنزیز سودوموناس آئروژینوزا نقش بازی میکنند. ازجمله فاکتورهای سطحی، پیلی، فلاژل و لایههای پلیساکاریدی مشتق از لیپوپلیساکاریدها که در اتصال و کلونیزاسیون درگیر هستند. پروتئینهایی از این باکتری ترشح میشوند که نقش مهمی در تخریب و آسیب به افتها دارند در این باکتریها انواع ژنهای کروموزومی و پلاسمیدهای مقاومت در ایجاد مقاومت باکتریها در برابر عوامل ضد میکروبی درگیر هستند (2).
تاکنون مصرف آنتیبیوتیکها در کاهش مرگومیر عفونتهای باکتریایی موفق نبوده است. این میکروارگانیسم از طریق تعداد زیادی از مکانیسمهای شایع مقاومت دارویی همچون نفوذپذیری کم غشاء خارجی و انواع پمپهای انتشار، مقاومت آنتیبیوتیکی قابلتوجهی از خود نشان داده است (3). بنابراین ایمونوپروفیلاکسی و ایمونوتراپی ممکن است بهعنوان روشهایی مؤثر در درمان و کنترل عفونتهای سودوموناس آئروژینوزا مطرح باشند. بر این اساس فاکتورهای مختلفی ازجمله لیپوپلیساکاریدها، اگزوتوکسین A، ریبوزوم، فلاژل، پیلی، پلیساکاریدهای با وزن مولکولی بالا، آلژینات و پروتئینهای غشاء خارجی، کونژوگههای چند ترکیبی، DNA واکسنها و پروتئینهای سیستم ترشحی III بهعنوان کاندیدای واکسن مورد توجه قرار گرفته است. علیرغم مطالعات بسیار در جهت توسعه و تولید واکسن علیه عفونتهای سودوموناس، هنوز واکسن مناسب با تأثیر پایدار و مؤثر در برابر عفونتهای این باکتری مورد تأیید قرار نگرفته است (4، 5).
استفاده از ترکیبات نانوذرات در عصر حاضر در بخشهای مختلف پزشکی، بهداشت و صنایع در حال افزایش است. ازجمله این کاربردها در تهیه نانوواکسنها است که دارای دو نقش عمده نانوحامل (حمل آنتیژنهای واکسن) و اثرات ادجوانتی هستند. از نانوذرات بهصورتهای ترکیب و یا کونژوگه شده با بیومولکولها برای القاء پاسخهای ایمنی مناسب و واکسیناسیون استفاده میشود (6). نانوحاملهای جامد برای تحویل بخشهای پروتئینی واکسن و ورود آسان به داخل روده و ارائه به به افتهای لنفوئیدی و موکوسی مفید هستند (7).
بنابراین در این مطالعه باهدف دستیابی به یک ترکیب جدید کاندید واکسن برای عفونتهای سودوموناس آئروژینوزا، نانوذرات طلا به دلیل خاصیت ادجوانتی بدون اثرات جانبی و زیست سازگاری بالا، با اگزوتوکسین A کونژوگه شده و اثرات القاء پاسخ ایمنی آن مورد بررسی قرار گرفت.
مواد و روش کار
تهیه و تخلیص اگزوتوکسین A ذاتی (Native):
سودوموناس آئروژینوزا سویه PAO1 تهیه شده از دانشگاه علوم پزشکی مراغه در محیط کشت نوترینت آگار حاوی شیر بدون چربی (Skim milk) کشت داده شد. بهمنظور بررسی توکسینزایی، ابتدا از باکتریهای کشت داده شده سوسپانسیون تهیه شد. سپس 4/0 میلیلیتر از این سوسپانسیون به 250 میلیلیتر محیط TSB دیالیز شده حاوی گلیسرول (1 درصد) و مونوسدیم گلوتامات (1 مولار) اضافه گردید و در دمای 37 درجه سانتیگراد به مدت 24 ساعت انکوبه شد. در ادامه سوسپانسیون تهیه شده سانتریفوژ شده و محلول رویی حاوی توکسین در دمای 4 درجه نگهداری شد. جهت جداسازی و تخلیص نسبی توکسین، از روشهای رسوبی انتخابی استفاده شد. برای این منظور سیترات سدیم (3/0 مولار) به میزان 1/0 از حجم سوسپانسیون اضافه شده و در مقابل بافر تریس (01/0 مولار) به مدت 24 ساعت در دمای 4 درجه سانتیگراد دیالیز شد. سپس بافر حاوی توکسین سانتریفوژ شده و به مایع رویی حاوی توکسین به میزان 1/0 از حجم مایع سولفات آمونیوم (60 درصد اشباء) افزوده شد. سپس مایع به دست آمده سانتریفوژ شده و دیالیز گردید. بهمنظور تخلیص و تغلیظ هر چه بیشتر توکسین به دست آمده، محلول حاوی توکسین به مدت 20 دقیقه در دمای اتاق سانتریفوژ گردید. جهت تأیید وجود و خلوص توکسین، از روش الکتروفورز بر روی ژل پلی آکریل آمید (SDS-PAGE) با غلظت 10 درصد و رنگ آمیزی نیترات نقره و کوماسی آبی استفاده شد. در ادامه توکسوئید اگزوتوکسین A (5 میلیلیتر) در بافر فسفات سالین (10 میلیلیتر) حاوی فسفات سدیم (01/0 مولار)، کلرید سدیم (15/0 مولار) و فرمالدهید (4 درصد) مخلوط شد و به مدت 4 روز در دمای 37 درجه سانتیگراد انکوبه گردید. در نهایت محلول به دست آمده در مقابل بافر فسفات دیالیز شده و توسط فیلتر سرسرنگی (45/0 میکرومتر) استریل گردید (8).
تهیه اگزوتوکسین A نوترکیب:
جهت تهیه اگزوتوکسین A نوترکیب، DNA ژنومی از کشت سودوموناس آئروژینوزا با استفاده از دستورالعمل کیت اختصاصی (سیناژن، ایران) استخراج گردید. سپس دمین I و II اگزوتوکسین A (بخشهای غیر توکسیک) با استفاده از روش واکنش زنجیرهای پلیمراز (PCR) و پرایمرهای اختصاصی طراحی شده تکثیر شد (پرایمر رفت: ΄5΄-CCGAGGAAGCCTTCGAC-3 و پرایمر برگشت: ΄5΄-GCCGTCGCCGAGGAACTC-3). در نهایت محصول به دست آمده از واکنش PCR بر روی ژل آگاروز 1 درصد الکتروفورز گردید. پس از تخلیص محصول PCR توسط ستون سیلیکا، طبق دستورالعمل کیت اختصاصی به وکتور PGEM منتقل گردید. سپس وکتور نوترکیب به باکتری اشرشیا کلی سویه DH5α انتقال داده شد. جهت جداسازی محصول کلونینگ از آنزیمهای محدود کننده BamH1 و Xho1 استفاده شد. در ادامه جهت تولید محصول ژن EXOA، از وکتور بیانی PET22b و میزبان اشرشیا کلی سویه BL21 استفاده شد. سپس چند کلونی از باکتری نوترکیب در محیط مایع LB حاوی آمپیسیلین کشت داده شده و توسط ایزوپروپیل بتا دی تیوگالاکتو پیرانوزوئید (IPTG) به مدت 4 ساعت القاء گردید. سپس سوسپانسیون تهیه شده سانتریفوژ شده و رسوب سلولی جمعآوری گردید. پس از اضافه کردن لیزوزیم (100 میکروگرم بر میلیلیتر) انکوباسیون به مدت 30 دقیقه در دمای اتاق، لیز سلولی با استفاده از اولتراسوند (10 تا 15 چرخه 45 ثانیهای در 4 درجه سانتیگراد) انجام شد. پس از افزودن DNase به لیز سلولی، به مدت 10 دقیقه و در دمای 4 درجه سانتیگراد سانتریفوژ انجام گرفت. محلول رویی و رسوب سلولی با استفاده از SDS-PAGE مورد بررسی قرار گرفت و میل ترکیبی آن با استفاده از کروماتوگرافی با رزین ارزیابی شد. در نهایت محلول به دست آمده در مقابل بافر فسفات دیالیز شده و توسط فیلتر سرسرنگی (45/0 میکرومتر) استریل گردید (9).
سنتز نانوذرات کروی طلا:
بهمنظور سنتز نانوذرات طلا، مقدار 9/3 میلیلیتر محلول آبی HAuCl4 (25/1 گرم طلا/لیتر) تهیه شده و 10 مرتبه رقیق گردید. سپس 1 میلیلیتر محلولتری سدیم سیترات (1 درصد) در حمام یخ افزوده شد. محلول به دست آمده توسط مگنت تفلونی به مدت 5 دقیقه هم زده شد. در ادامه 9/3 میلیلیتر محلول NaBH4 (02/0 مولار) تهیه شده و 5 مرتبه رقیق شد. محلول NaBH4 بهصورت قطرهای در مدت 3 دقیقه به محلول HAuCl4 قرار گرفته در حمام یخ افزوده شد و تا تغییر رنگ به قرمز هم زده شد و نانوذرات کروی طلا تهیه شده جهت کونژوگاسیون مورد استفاده قرار گرفت (10).
کونژوگاسیون اگزوتوکسین A با نانوذرات طلا:
جهت کونژوگاسیون اگزوتوکسین A نوترکیب و ذاتی با نانوذرات طلا، مقدار 10 میلیگرم از سطح حاوی نانوذرات طلا در 5 میلیلیتر بافر KCl-HCl (02/0 مولار) دیسپرس شد. سپس 100 میکرولیتر از هر کدام از محلولهای حاوی اگزوتوکسین نوترکیب و ذاتی (10 میلیگرم بر میلیلیتر) در بافر KCl-HCl افزوده شد و به مدت 2 ساعت هم زده شد. به این طریق نیروی الکترواستاتیک موجب کونژوگاسیون کردید. در نهایت ارزیابی کونژوگاسیون با استفاده از میکروسکوپ الکترونی و طیفسنجی تبدیل فوریه فروسرخ (FTIR) استفاده شد (11).
یافتهها
نتایج تهیه و تخلیص اگزوتوکسین A ذاتی:
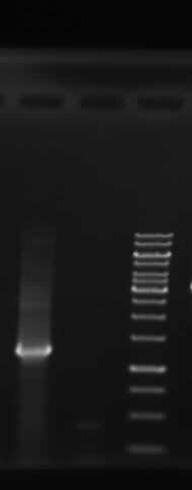
در مطالعه حاضر جهت بررسی وجود و خلوص اگزوتوکسین A ذاتی از روش الکتروفورز بر روی ژل پلی آکریل آمید (SDS-PAGE) و رنگ آمیزی نیترات نقره استفاده شد. نتایج به دست آمده تأیید کننده غلظت و خلوص نسبی اگزوتوکسین A تهیه شده بود (شکل 1).
سودوموناس آئروژینوزا یک باکتری گرم منفی و پاتوژن فرصت طلبی است که عموماً موجب ایجاد عفونت بیمارستانی شده و به سیستم ایمنی آسیب میرساند. سودوموناس آئروژینوزا همراه با چند عامل عفونت دیگر، در بیماران با سوختگی و سیستیک فیبروزیس که داروهای تضعیف کننده سیستم ایمنی را دریافت میکند، بروز میکند (1). این باکتری بهطور متداول از زخمهای بزاق یا خلط، خون و دیگر نمونههای کلینیکی و از عفونتهای بیمارستانی جدا شده است. سپتی سمی سودوموناس آئروژینوزا بخصوص در بیماران دچار سوختگی مرگومیر بالایی دارد. فاکتورهای ویرولانس مختلفی در پاتوژنزیز سودوموناس آئروژینوزا نقش بازی میکنند. ازجمله فاکتورهای سطحی، پیلی، فلاژل و لایههای پلیساکاریدی مشتق از لیپوپلیساکاریدها که در اتصال و کلونیزاسیون درگیر هستند. پروتئینهایی از این باکتری ترشح میشوند که نقش مهمی در تخریب و آسیب به افتها دارند در این باکتریها انواع ژنهای کروموزومی و پلاسمیدهای مقاومت در ایجاد مقاومت باکتریها در برابر عوامل ضد میکروبی درگیر هستند (2).
تاکنون مصرف آنتیبیوتیکها در کاهش مرگومیر عفونتهای باکتریایی موفق نبوده است. این میکروارگانیسم از طریق تعداد زیادی از مکانیسمهای شایع مقاومت دارویی همچون نفوذپذیری کم غشاء خارجی و انواع پمپهای انتشار، مقاومت آنتیبیوتیکی قابلتوجهی از خود نشان داده است (3). بنابراین ایمونوپروفیلاکسی و ایمونوتراپی ممکن است بهعنوان روشهایی مؤثر در درمان و کنترل عفونتهای سودوموناس آئروژینوزا مطرح باشند. بر این اساس فاکتورهای مختلفی ازجمله لیپوپلیساکاریدها، اگزوتوکسین A، ریبوزوم، فلاژل، پیلی، پلیساکاریدهای با وزن مولکولی بالا، آلژینات و پروتئینهای غشاء خارجی، کونژوگههای چند ترکیبی، DNA واکسنها و پروتئینهای سیستم ترشحی III بهعنوان کاندیدای واکسن مورد توجه قرار گرفته است. علیرغم مطالعات بسیار در جهت توسعه و تولید واکسن علیه عفونتهای سودوموناس، هنوز واکسن مناسب با تأثیر پایدار و مؤثر در برابر عفونتهای این باکتری مورد تأیید قرار نگرفته است (4، 5).
استفاده از ترکیبات نانوذرات در عصر حاضر در بخشهای مختلف پزشکی، بهداشت و صنایع در حال افزایش است. ازجمله این کاربردها در تهیه نانوواکسنها است که دارای دو نقش عمده نانوحامل (حمل آنتیژنهای واکسن) و اثرات ادجوانتی هستند. از نانوذرات بهصورتهای ترکیب و یا کونژوگه شده با بیومولکولها برای القاء پاسخهای ایمنی مناسب و واکسیناسیون استفاده میشود (6). نانوحاملهای جامد برای تحویل بخشهای پروتئینی واکسن و ورود آسان به داخل روده و ارائه به به افتهای لنفوئیدی و موکوسی مفید هستند (7).
بنابراین در این مطالعه باهدف دستیابی به یک ترکیب جدید کاندید واکسن برای عفونتهای سودوموناس آئروژینوزا، نانوذرات طلا به دلیل خاصیت ادجوانتی بدون اثرات جانبی و زیست سازگاری بالا، با اگزوتوکسین A کونژوگه شده و اثرات القاء پاسخ ایمنی آن مورد بررسی قرار گرفت.
مواد و روش کار
تهیه و تخلیص اگزوتوکسین A ذاتی (Native):
سودوموناس آئروژینوزا سویه PAO1 تهیه شده از دانشگاه علوم پزشکی مراغه در محیط کشت نوترینت آگار حاوی شیر بدون چربی (Skim milk) کشت داده شد. بهمنظور بررسی توکسینزایی، ابتدا از باکتریهای کشت داده شده سوسپانسیون تهیه شد. سپس 4/0 میلیلیتر از این سوسپانسیون به 250 میلیلیتر محیط TSB دیالیز شده حاوی گلیسرول (1 درصد) و مونوسدیم گلوتامات (1 مولار) اضافه گردید و در دمای 37 درجه سانتیگراد به مدت 24 ساعت انکوبه شد. در ادامه سوسپانسیون تهیه شده سانتریفوژ شده و محلول رویی حاوی توکسین در دمای 4 درجه نگهداری شد. جهت جداسازی و تخلیص نسبی توکسین، از روشهای رسوبی انتخابی استفاده شد. برای این منظور سیترات سدیم (3/0 مولار) به میزان 1/0 از حجم سوسپانسیون اضافه شده و در مقابل بافر تریس (01/0 مولار) به مدت 24 ساعت در دمای 4 درجه سانتیگراد دیالیز شد. سپس بافر حاوی توکسین سانتریفوژ شده و به مایع رویی حاوی توکسین به میزان 1/0 از حجم مایع سولفات آمونیوم (60 درصد اشباء) افزوده شد. سپس مایع به دست آمده سانتریفوژ شده و دیالیز گردید. بهمنظور تخلیص و تغلیظ هر چه بیشتر توکسین به دست آمده، محلول حاوی توکسین به مدت 20 دقیقه در دمای اتاق سانتریفوژ گردید. جهت تأیید وجود و خلوص توکسین، از روش الکتروفورز بر روی ژل پلی آکریل آمید (SDS-PAGE) با غلظت 10 درصد و رنگ آمیزی نیترات نقره و کوماسی آبی استفاده شد. در ادامه توکسوئید اگزوتوکسین A (5 میلیلیتر) در بافر فسفات سالین (10 میلیلیتر) حاوی فسفات سدیم (01/0 مولار)، کلرید سدیم (15/0 مولار) و فرمالدهید (4 درصد) مخلوط شد و به مدت 4 روز در دمای 37 درجه سانتیگراد انکوبه گردید. در نهایت محلول به دست آمده در مقابل بافر فسفات دیالیز شده و توسط فیلتر سرسرنگی (45/0 میکرومتر) استریل گردید (8).
تهیه اگزوتوکسین A نوترکیب:
جهت تهیه اگزوتوکسین A نوترکیب، DNA ژنومی از کشت سودوموناس آئروژینوزا با استفاده از دستورالعمل کیت اختصاصی (سیناژن، ایران) استخراج گردید. سپس دمین I و II اگزوتوکسین A (بخشهای غیر توکسیک) با استفاده از روش واکنش زنجیرهای پلیمراز (PCR) و پرایمرهای اختصاصی طراحی شده تکثیر شد (پرایمر رفت: ΄5΄-CCGAGGAAGCCTTCGAC-3 و پرایمر برگشت: ΄5΄-GCCGTCGCCGAGGAACTC-3). در نهایت محصول به دست آمده از واکنش PCR بر روی ژل آگاروز 1 درصد الکتروفورز گردید. پس از تخلیص محصول PCR توسط ستون سیلیکا، طبق دستورالعمل کیت اختصاصی به وکتور PGEM منتقل گردید. سپس وکتور نوترکیب به باکتری اشرشیا کلی سویه DH5α انتقال داده شد. جهت جداسازی محصول کلونینگ از آنزیمهای محدود کننده BamH1 و Xho1 استفاده شد. در ادامه جهت تولید محصول ژن EXOA، از وکتور بیانی PET22b و میزبان اشرشیا کلی سویه BL21 استفاده شد. سپس چند کلونی از باکتری نوترکیب در محیط مایع LB حاوی آمپیسیلین کشت داده شده و توسط ایزوپروپیل بتا دی تیوگالاکتو پیرانوزوئید (IPTG) به مدت 4 ساعت القاء گردید. سپس سوسپانسیون تهیه شده سانتریفوژ شده و رسوب سلولی جمعآوری گردید. پس از اضافه کردن لیزوزیم (100 میکروگرم بر میلیلیتر) انکوباسیون به مدت 30 دقیقه در دمای اتاق، لیز سلولی با استفاده از اولتراسوند (10 تا 15 چرخه 45 ثانیهای در 4 درجه سانتیگراد) انجام شد. پس از افزودن DNase به لیز سلولی، به مدت 10 دقیقه و در دمای 4 درجه سانتیگراد سانتریفوژ انجام گرفت. محلول رویی و رسوب سلولی با استفاده از SDS-PAGE مورد بررسی قرار گرفت و میل ترکیبی آن با استفاده از کروماتوگرافی با رزین ارزیابی شد. در نهایت محلول به دست آمده در مقابل بافر فسفات دیالیز شده و توسط فیلتر سرسرنگی (45/0 میکرومتر) استریل گردید (9).
سنتز نانوذرات کروی طلا:
بهمنظور سنتز نانوذرات طلا، مقدار 9/3 میلیلیتر محلول آبی HAuCl4 (25/1 گرم طلا/لیتر) تهیه شده و 10 مرتبه رقیق گردید. سپس 1 میلیلیتر محلولتری سدیم سیترات (1 درصد) در حمام یخ افزوده شد. محلول به دست آمده توسط مگنت تفلونی به مدت 5 دقیقه هم زده شد. در ادامه 9/3 میلیلیتر محلول NaBH4 (02/0 مولار) تهیه شده و 5 مرتبه رقیق شد. محلول NaBH4 بهصورت قطرهای در مدت 3 دقیقه به محلول HAuCl4 قرار گرفته در حمام یخ افزوده شد و تا تغییر رنگ به قرمز هم زده شد و نانوذرات کروی طلا تهیه شده جهت کونژوگاسیون مورد استفاده قرار گرفت (10).
کونژوگاسیون اگزوتوکسین A با نانوذرات طلا:
جهت کونژوگاسیون اگزوتوکسین A نوترکیب و ذاتی با نانوذرات طلا، مقدار 10 میلیگرم از سطح حاوی نانوذرات طلا در 5 میلیلیتر بافر KCl-HCl (02/0 مولار) دیسپرس شد. سپس 100 میکرولیتر از هر کدام از محلولهای حاوی اگزوتوکسین نوترکیب و ذاتی (10 میلیگرم بر میلیلیتر) در بافر KCl-HCl افزوده شد و به مدت 2 ساعت هم زده شد. به این طریق نیروی الکترواستاتیک موجب کونژوگاسیون کردید. در نهایت ارزیابی کونژوگاسیون با استفاده از میکروسکوپ الکترونی و طیفسنجی تبدیل فوریه فروسرخ (FTIR) استفاده شد (11).
یافتهها
نتایج تهیه و تخلیص اگزوتوکسین A ذاتی:
در مطالعه حاضر جهت بررسی وجود و خلوص اگزوتوکسین A ذاتی از روش الکتروفورز بر روی ژل پلی آکریل آمید (SDS-PAGE) و رنگ آمیزی نیترات نقره استفاده شد. نتایج به دست آمده تأیید کننده غلظت و خلوص نسبی اگزوتوکسین A تهیه شده بود (شکل 1).

شکل (1): الکتروفورز اگزوتوکسین A در رنگ آمیزی با نیترات نقره بر روی ژل آگارز.
نتایج تهیه اگزوتوکسین A نوترکیب:
محصول تکثیر اولیه ژن EXOA سودوموناس آئروژینوزا توسط PCR بر روی ژل آگاروز 1 درصد الکتروفورز گردید (شکل 2). پس از تخلیص قطعه ژنی EXOA و انتقال به وکتور PET22b و کلونینگ در میزبال اشرشیا کلی، سطح بالایی از بیان پروتئین نوترکیب به دست آمد که توسط الکتروفورز بر روی ژل پلی آکریل آمید (SDS-PAGE) لیزات سلول باکتریایی تأیید شد (شکل 3). همچنین رنگ آمیزی با کوماسی نشاندهنده بیان پروتئین 66 کیلودالتونی (KDa) با غلظت بالا بود (شکل 4).

شکل (2): الکتروفورز محلول تکثیر ژن EXOA بر روی ژل آگارز.
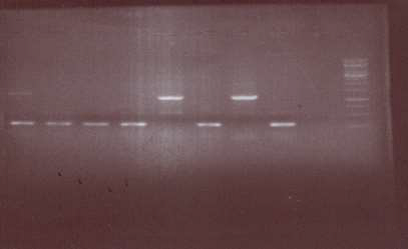
شکل (3): الکتروفورز محصول هضم آنزیمی وکتور نوترکیب PET22b-EXOA با آنزیمهای BamH1 و XHOI بر روی ژل آگارز.

شکل (4): بیان اگزوتوکسین A و نوترکیب با SDS-PAGE رسوب اگزوتوکسین قبل از القاء و سوسپانسیون و اگزوتوکسین پس از القاء با IPTG.

شکل (3): الکتروفورز محصول هضم آنزیمی وکتور نوترکیب PET22b-EXOA با آنزیمهای BamH1 و XHOI بر روی ژل آگارز.

شکل (4): بیان اگزوتوکسین A و نوترکیب با SDS-PAGE رسوب اگزوتوکسین قبل از القاء و سوسپانسیون و اگزوتوکسین پس از القاء با IPTG.
نتایج کونژوگاسیون اگزوتوکسین A با نانوذرات طلا:
نتایج به دست آمده نشان داد که اندازه متوسط نانوذرات طلا بین 5 تا 10 نانومتر بوده و شکل ذرات تقریباً کروی است. نتایج به دست آمده نشان داد که نانوذرات طلا در اندازه کمتر از 10 نانومتر میتواند با اگزوتوکسین A نوترکیب و ذاتی کونژوگه شود (شکل 5).
نتایج به دست آمده نشان داد که اندازه متوسط نانوذرات طلا بین 5 تا 10 نانومتر بوده و شکل ذرات تقریباً کروی است. نتایج به دست آمده نشان داد که نانوذرات طلا در اندازه کمتر از 10 نانومتر میتواند با اگزوتوکسین A نوترکیب و ذاتی کونژوگه شود (شکل 5).

شکل (5): طیف FTIR نانو ذره طلا / اگزو توکسین A.
سودوموناس آئروژینوز اغلب بهعنوان یک پاتوژن فرصت طلب محسوب شده و موجب ایجاد عفونتهای بیمارستانی در بیماران مبتلا به نقص سیستم ایمنی و سوختگیهای شدید میشود. یکی از فاکتورهای بیماریزا و سمی که توسط این باکتری تولید میشود اگزوتوکسین A میباشد (12). اگزوتوکسین A از طریق آندوسیتوز به سیتوپلاسم سلولی وارد شده و فاکتورهای رونویسی را غیر فعال کرده و مانع سنتز پروتئین و پاسخ ایمنی همورال میشود (13). بنابراین در مطالعه حاضر تولید و خواص خواص کونژوگه اگزوتوکسین A سودوموناس آئروژینوزا با نانوذره طلا مورد بررسی قرار گرفت.
در مطالعه حاضر از باکتری سودوموناس آئروژینوز سویه PAO1 برای تخلیص اگزوتوکسین A ذاتی استفاده شد و سپس اگزوتوکسین A نوترکیب از طریق کلون در اشرشیا کلی تهیه شد. در نهایت خواص کونژوگه اگزوتوکسین A با نانوذره طلا مورد ارزیابی قرار گرفت. نتایج به دست آمده نشان داد که اگزوتوکسین A ذاتی سودوموناس آئروژینوزا با خلوص بالا قابل استخراج است.
تخلیص اگزوتوکسین A ذاتی مشکلات بسیار و بازده پایینی داشته و تولید نوترکیب آن در مطالعات مختلف مورد توجه قرار گرفته است (14، 15). در مطالعه حاضر دمین I و II (دمین اتصال به گیرنده) کلون و تکثیر شد که یک ترکیب غیر سمی از اگزوتوکسین A میباشد. نتایج به دست آمده نشان داد که تولید اگزوتوکسین A نوترکیب در غلظت بالا امکانپذیر است. شواهد نشان میدهد این دمین اثرات سمیت اگزوتوکسین A را خنثی میکند (16، 17). بنابراین در مطالعه حاضر پس از تخلیص و تهیه اگزوتوکسین A ذاتی و نوترکیب، با نانوذرات طلا کونژوگه شدند. نتایج به دست آمده نشان داد که نانوذرات طلا با هر دو اگزوتوکسین A ذاتی و نوترکیب بهخوبی کونژوگه میشود. همچنین نتایج حاصل از موشهای ایمن شده، ایمنی بالایی با اگزوتوکسین A و نانو ذره طلا و همچنین با اگزوتوکسین A به تنهایی و نانو ذره طلا به تنهایی در مقابل تزریق داخل صفاقی نشان داد. این نتایج مشابه مطالعات Eftekharivash و همکاران (17) و Zawrah و همکاران (18) و Nazari و همکاران (19) میباشد. آنها در مطالعات خود محافظتهای معنیداری را برای گروههای موشی ایمن شده با EXOA-OprF-OprI، اما محافظت ضعیفی را برای گروههای ایمن شده با اگزو توکسین A نوترکیب گزارش کردند. بررسی مرگ موشها در گروههای مختلف ایمن شده با آنتی ژنهای مختلف نشان داد که موشهای محافظت نشده در گروههای مختلف ازجمله گروههای ایمن شده با اگزوتوکسین A در مقایسه با شاهد تلف شدند. این نتایج نشان داد ایمنی زایی با اگزوتوکسین A در ترکیب با نانو ذره طلا در خنثی کردن اثرات سمی و کشنده نقش دارد. در مطالعه مشابهی Cryz و همکاران نشان دادند که اگزوتوکسین A کونژوگه شده با زنجیره O از LPS سودوموناس آئروژینوزا یک ترکیب ایمنی زا غیر توکسیک و غیر تب زا است (20)
نانوذرات طلا با اندازه 10 نانومتر به شکل کروی بهعنوان عامل ضد باکتریایی مؤثر برای درمان عفونتهای ناشی از باکتریهای مختلف مورد بررسی قرار گرفته است. از مهمترین ویژگیهای نانوذرات طلا، اندازه بسیار کوچک با فضای سطحی بزرگ است که باعت افزایش فعالیتهای شیمیایی و بیولوژیکی انحلال پذیری و تحرک بسیار زیاد در بدن انسان و توانایی نفوذ به غشاء سلولی و خاصیت ضد باکتریایی و ضد سرطانی است (21). شواهد نشان میدهد که نانوذرات طلا با اتصال به میکروارگانیسمها موجب آسیب به غشاء سیتوپلاسمی و آسیب به فلاژلها میشود (22). همچنین نانوذرات طلا دارای ویژگیهای مطلوب دیگری نیز هستند که آنها را بهعنوان اهداف عالی برای استفاده در برنامههای تحویل دارو مطرح میسازد. هسته طلا بهطور ذاتی بی اثر، غیر سمی و سازگار با محیط زیست است و این امر نقطه شروع ایدهآل برای ساخت حاملهای دارویی میباشد. علاوه بر این نانوذرات طلا را میتوان با اندازههای مختلف (1 تا 15 نانومتر) و ابعاد متناسب با پروتئینها و دیگر مولکولهای آلی به راحتی تولید کرد (23، 24).
پژوهشهای مختلف مکانیسمهای ضد باکتریایی نانوذرات طلا را توضیح دادهاند؛ نانوذرات طلا پیوند محکمی با غشاء خارجی باکتری برقرار میکند و مانع فعالیتهای سلولی ازجمله انتقال فعال، فعالیتهای آنزیمی پری پلاسمیک و دهیدروژناز شده و در نهایت از سنتز DNA و RNA و پروتئین جلوگیری کرده و موجب لیز سلولی میشوند (25، 26). همچنین نشان داده شده است که نانوذرات طلا میتوانند آنتیبیوتیکها را به دور از آنزیمهای دفاعی باکتریایی، به هدف و گیرنده خود برسانند (27). در یک مطالعه مشابه توسط Nazari و همکاران اثرات نانوذرات طلا بر روی سودوموناس آئروژینوزا مقاوم به آنتیبیوتیک مورد بررسی قرار دادند. نتایج آنها نشان داد که نانوذرات طلا به شکل پایدار با آنتیبیوتیک کونژوگه شده و اثرات ضد میکروبی آنتیبیوتیکها را ارتقاء میدهند (19).
بهطور کلی مطالعه حاضر نشان داد که نانوذرات طلا قابلیت کونژوگاسیون با اگزوتوکسین را داشته و میتواند بهعنوان ادجوانت در تهیه واکسن اگزوتوکسین در عفونتهای بیمارستانی مورد توجه قرار گیرد. با توجه به این نتایج، استفاده از نانوذرات طلا کونژوگه با پروتئینهای باکتریایی میتواند بهعنوان یک استراتژی بالقوه برای تولید واکسنهای میکروبی در نظر گرفته شود. همچنین ممکن است این قابلیت در تشخیص بیماریهای عفونی برای توسعه دستگاههای تشخیصی مفید باشد.
تشکر و قدردانی
این مطالعه مستخرج از پایان نامه دکتری معصومه عباسی میباشد. نویسندگان از همه اعضای آزمایشگاه میکروبیولوژی دانشگاه علوم پزشکی مراغه جهت همکاری در این مطالعه قدردانی مینمایند.
نوع مطالعه: پژوهشي(توصیفی- تحلیلی) |
موضوع مقاله:
میکروبیولوژی
فهرست منابع
1. Mesaros N, Nordmann P, Plésiat P, Roussel-Delvallez M, Van Eldere J, Glupczynski Y, et al. Pseudomonas aeruginosa: resistance and therapeutic options at the turn of the new millennium. Clin Microbiol Infect 2007;13(6):560-78. [DOI:10.1111/j.1469-0691.2007.01681.x] [PMID]
2. Oruji F, Baghbani Arani F, Mahdavi Ortakand M. Evaluation of the gene expression of IL-1β and Casp-1 related to inflammation process in glomerulonephritis patients. J Anim Environ 2018;10(3):477-82. [Google Scholar]
3. Mahdavi S, Hajazimian S, Isazadeh A, Babash Pour M, Shishehgar R. Study of the antioxidant and antimicrobial effects of the ethanolic extract of Eucalyptus camaldulensis Dehnh against infectious bacteria isolated from clinical and animal sources. J Compar Pathobiol 2017;13(4):2063-70. [Google Scholar]
4. Holder IA. Pseudomonas immunotherapy: a historical overview. Vaccine 2004;22(7):831-9. [DOI:10.1016/j.vaccine.2003.11.028] [PMID]
5. Hassett DJ, Korfhagen TR, Irvin RT, Schurr MJ, Sauer K, Lau GW, et al. Pseudomonas aeruginosa biofilm infections in cystic fibrosis: insights into pathogenic processes and treatment strategies. Expert Opin Ther Targets 2010;14(2):117-30. [DOI:10.1517/14728220903454988] [PMID]
6. Jadid MF, Shademan B, Chavoshi R, Seyyedsani N, Aghaei E, Taheri E, et al. Enhanced anticancer potency of hydroxytyrosol and curcumin by PLGA‐PAA nano‐encapsulation on PANC‐1 pancreatic cancer cell line. Environ Toxicol 2021;36(6):1043-51. [DOI:10.1002/tox.23103] [PMID]
7. Borges O, Borchard G, Verhoef JC, de Sousa A, Junginger HE. Preparation of coated nanoparticles for a new mucosal vaccine delivery system. Int J Pharm 2005;299(1-2):155-66. [DOI:10.1016/j.ijpharm.2005.04.037] [PMID]
8. Tanomand A, Najar Peerayeh S, Farajnia S, Majidi J. Protective properties of nontoxic recombinant exotoxin A (domain I-II) against Pseudomonas aeruginosa infection. Iran J Biotechnol 2013;11(3):193-8. [DOI:10.5812/ijb.10149]
9. Farajnia S, Peerayeh SN, Tanomand A, Majidi J, Goudarzi G, Naghili B, et al. Protective efficacy of recombinant exotoxin A-flagellin fusion protein against Pseudomonas aeruginosa infection. Can J Microbiol 2015;61(1):60-4. [DOI:10.1139/cjm-2014-0501] [PMID]
10. Michalska M, Wolf P. Pseudomonas Exotoxin A: optimized by evolution for effective killing. Front Microbiol 2015;6:963. [DOI:10.3389/fmicb.2015.00963] [PMID] [PMCID]
11. Abbasi M, Kafilzadeh F, Tanomand A, Zolghadri S, Hosainzadegan H. Gold Nanoparticles Conjugating Recombinant Nontoxic Pseudomonas Exotoxin A as a Vaccine Candidate for Pseudomonas aeruginosa Infections. Mol Genet Microbiol Virol 2021;36(Suppl 1):7-12. [DOI:10.3103/S0891416821050025]
12. Azam MW, Khan AU. Updates on the pathogenicity status of Pseudomonas aeruginosa. Drug Discov Today 2019;24(1):350-9. [DOI:10.1016/j.drudis.2018.07.003] [PMID]
13. Safari Zanjani L, Shapouri R, Dezfulian M, Mahdavi M, Shafiee Ardestani M. Exotoxin A-PLGA nanoconjugate vaccine against Pseudomonas aeruginosa infection: Protectivity in murine model. World J Microbiol Biotechnol 2019;35(6):1-9. [DOI:10.1007/s11274-019-2669-y] [PMID]
14. Shadman Z, Farajnia S, Pazhang M, Tohidkia M, Rahbarnia L, Najavand S, et al. Isolation and characterizations of a novel recombinant scFv antibody against exotoxin A of Pseudomonas aeruginosa. BMC Infect Dis 2021;21(1):1-9. (Persian) [DOI:10.1186/s12879-021-05969-0] [PMID] [PMCID]
15. Gholami N, Cohan RA, Razavi A, Bigdeli R, Dashbolaghi A, Asgary V. Cytotoxic and apoptotic properties of a novel nano‐toxin formulation based on biologically synthesized silver nanoparticle loaded with recombinant truncated pseudomonas exotoxin A. J Cell Physiol 2020;235(4):3711-20. (Persian) [DOI:10.1002/jcp.29265] [PMID]
16. Kaplan G, Mazor R, Lee F, Jang Y, Leshem Y, Pastan I. Improving the In Vivo Efficacy of an Anti-Tac (CD25) Immunotoxin by Pseudomonas Exotoxin A Domain II EngineeringHighly Active Engineered Anti-Tac (CD25) Immunotoxins. Mol Cancer Ther 2018;17(7):1486-93. [DOI:10.1158/1535-7163.MCT-17-1041] [PMID] [PMCID]
17. Eftekharivash L, Farajnia S, Najar Peerayeh S, Tanomand A. Optimization of expression and in vitro characteristics evaluation of Pseudomonas aeruginosa recombinant exotoxin A (domains I and II). J North Khorasan Uni Med Sci 2016;7(3):495-507. [DOI:10.29252/jnkums.7.3.495]
18. Zawrah MF, El-Moez SA, Center D. Antimicrobial activities of gold nanoparticles against major foodborne pathogens. Life Sci J 2011;8(4):37-44. [Google Scholar]
19. Nazari ZE, Banoee M, Sepahi AA, Rafii F, Shahverdi AR. The combination effects of trivalent gold ions and gold nanoparticles with different antibiotics against resistant Pseudomonas aeruginosa. Gold Bull 2012;45(2):53-9. (Persian) [DOI:10.1007/s13404-012-0048-7]
20. Cryz Jr SJ, Fiirer E, Sadoff JC, Germanier R, Pastan I, Willingham MC, et al. Use of Pseudomonas aeruginosa toxin A in the construction of conjugate vaccines and immunotoxins. Rev Infect Dis 1987;9(Supplement 5):644-9. [DOI:10.1093/clinids/9.Supplement_5.S644] [PMID]
21. Li C, Li D, Wan G, Xu J, Hou W. Facile synthesis of concentrated gold nanoparticles with low size-distribution in water: temperature and pH controls. Nanoscale Res Lett 2011;6(1):440.
https://doi.org/10.1186/1556-276X-9-440 [DOI:10.1186/1556-276X-6-440]
22. Shah M, Badwaik V, Kherde Y, Waghwani HK, Modi T, Aguilar ZP, et al. Gold nanoparticles: various methods of synthesis and antibacterial applications. Front Biosci 2014;19(8):1320-44. [DOI:10.2741/4284] [PMID]
23. Rana S, Bajaj A, Mout R, Rotello VM. Monolayer coated gold nanoparticles for delivery applications. Adv Drug Deliv Rev 2012;64(2):200-16. [DOI:10.1016/j.addr.2011.08.006] [PMID] [PMCID]
24. Massich MD, Giljohann DA, Schmucker AL, Patel PC, Mirkin CA. Cellular Response of Polyvalent Oligonucleotide− Gold Nanoparticle Conjugates. ACS Nano 2010;4(10):5641-6. [DOI:10.1021/nn102228s] [PMID] [PMCID]
25. Cai W, Gao T, Hong H, Sun J. Applications of gold nanoparticles in cancer nanotechnology. Nanotechnol Sci Appl 2008;1:17-32. [DOI:10.2147/NSA.S3788] [PMID] [PMCID]
26. Chen YS, Hung YC, Liau I, Huang GS. Assessment of the in vivo toxicity of gold nanoparticles. Nanoscale Res Lett 2009;4(8):858-64. [DOI:10.1007/s11671-009-9334-6] [PMID] [PMCID]
27. Connor EE, Mwamuka J, Gole A, Murphy CJ, Wyatt MD. Gold nanoparticles are taken up by human cells but do not cause acute cytotoxicity. [Google Scholar]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







