دوره 35، شماره 1 - ( 1-1403 )
جلد 35 شماره 1 صفحات 9-1 |
برگشت به فهرست نسخه ها
Research code: 62201
Ethics code: IR.TBZMED.REC.1394.795
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Shafiei-Irannejad V, Zarghami N, Samadi N, Akbarzadeh A. EXAMINING THE EFFECT OF METFORMIN ON ENHANCING THE SENSITIVITY OF CISPLATIN-RESISTANT OVARIAN CANCER CELLS (A2780/CP). Studies in Medical Sciences 2024; 35 (1) :1-9
URL: http://umj.umsu.ac.ir/article-1-6207-fa.html
URL: http://umj.umsu.ac.ir/article-1-6207-fa.html
شفیعی ایران نژاد وحید، ضرغامی نصرت اله، صمدی ناصر، اکبرزاده ابوالفضل. بررسی تأثیر متفورمین بر افزایش حساسیت سلولهای سرطان تخمدان مقاوم به سیس پلاتین (A2780 / CP). مجله مطالعات علوم پزشکی. 1403; 35 (1) :1-9
استادیار بیوشیمی بالینی، مرکز تحقیقات سلولی و مولکولی، دانشگاه علوم پزشکی ارومیه، ارومیه، ایران (نویسنده مسئول) ، vahid.shafiei@hotmail.com
متن کامل [PDF 606 kb]
(796 دریافت)
| چکیده (HTML) (3396 مشاهده)
شرایط PCR شامل 95 درجه سانتیگراد به مدت 4 دقیقه و سپس 40 چرخه 95 درجه سانتیگرادی به مدت 10 ثانیه، 60 درجه سانتیگراد به مدت 35 ثانیه و 72 درجه سانتیگراد به مدت 20 ثانیه بود. تمام آزمایشها در سه تکرار انجام شد و برای هر نمونه مقدار آستانه سیکل (Ct) برای ژن هدف و GAPDH بهعنوان ژن مرجع داخلی تعیین شد. سطح بیان mRNA نسبی ژن هدف به سطح بیان GAPDH نرمال شد، که امکان محاسبه cDNA هدف را فراهم کرد.
بررسی آپوپتوز به روش فلوسایتومتری:
اثرات آپوپتوتیک متفورمین بر روی سلولهای A2780/CP با استفاده از کیت ApoFlowEx® FITC (EXBIO Diagnostics، جمهوری چک) انجام شد. سلولها در صفحات 6 چاهکی با تراکم 5 × 105 سلول در هر چاهک کشت داده شدند. پس از 24 ساعت سلولها با سیس پلاتین تنها، ترکیب متفورمین و سیس پلاتین و محیط تازه بهعنوان گروه کنترل تیمار شدند و به مدت 48 ساعت انکوبه شدند. سپس سلولها جدا شدند، دو بار با PBS شسته شدند،
سلولها مجدداً در 500 میکرولیتر از بافر اتصال مخلوط شدند، 5 میکرولیتر Annexin V-FITC و سپس 5 میکرولیتر پروپیدیوم یدید اضافه شد. سلولها به مدت 15 دقیقه در تاریکی انکوبه شدند و با استفاده از دستگاه فلوسایتومتری (FACSCalibur, BD Biosciences, San Jose, CA, USA) آنالیز شدند.
آنالیز آماری:
تمامی دادهها بهصورت میانگین ± انحراف معیار بیان شد و تمام آزمایشها در سه تکرار انجام شد. تجزیهوتحلیل واریانس یکطرفه (ANOVA) برای توضیح تفاوت بین گروهها موردبررسی قرار گرفت. مقادیر P کمتر از 0.05 ازنظر آماری معنیدار در نظر گرفته شد. تمامی دادهها با استفاده از نرمافزار GraphPad Prism 6.01 تجزیهوتحلیل شدند.
یافتهها
تأیید فنوتیپ مقاوم در سلولهای سرطان تخمدان:
سلولهای A2780/CP به سیس پلاتین مقاوم بودند، همانطور که سمیت بالاتر در سلولهای A2780/S تأیید شد. تفاوت قابلتوجهی در بیان ژن MRP-2 در سلولهای A2780 و A2780/CP مشاهده نشد، که نشان میدهد مقاومت در A2780/CP به سیس پلاتین به دلیل بیان بالاتر MRP-2 نیست و مکانیسمهای دیگری ممکن است در سرطان تخمدان نسبت به مقامت به سیس پلاتین دخیل باشند.
متفورمین سمیت سلولی را در سلولهای مقاوم به سیس پلاتین افزایش داد:
همانطور که در شکل 2 نشان داده شده است، متفورمین سمیت سلولی تقریباً برابری را علیه تمام سلولهای سرطان پستان حساس و مقاوم تیمار شده اعمال کرد. در غلظتهای 5-15 میلیمولار متفورمین اثر بازدارندگی پایینی داشت، درحالیکه اثرات سمی در دوزهای بالاتر از 20 میلیمولار مشاهده شد. انحراف به چپ در پروفایل سمیت سیس پلاتین پس از افزودن متفورمین نشان میدهد که متفورمین سمیت سلولی سیس پلاتین را در سلولهای A2780/CP افزایش میدهد، درحالیکه هیچ تأثیری بر سمیت سلولی سیس پلاتین در سلولهای حساس نداشت. درمان با متفورمین در سلولهای مقاوم بهطور قابلتوجهی مقادیر IC50 سیس پلاتین و RF را کاهش داد، که نشان میدهد متفورمین میتواند MDR را در سلولهای A2780/CP معکوس کند.
.jpg)

بحث و نتیجهگیری
اگرچه سیس پلاتین جزء ترکیبات ضد سرطانی قوی و پرکاربردی هست، درمان با این دارو با عوارض جانبی شدید بهویژه سمیت کلیوی همراه است که بیشتر به غلظت دارو بستگی دارد (18). برای کاهش عوارض جانبی سمی سیس پلاتین یک رویکرد استفاده همزمان آن با ترکیبات بیخطر و با عوارض جانبی کم هست. در این مطالعه مشاهده کردیم که ترکیب متفورمین در غلظتهای غیر سمی با سیس پلاتین، IC50 را در سلولهای A2780/CP کاهش داد، که نشان میدهد متفورمین ممکن است عوارض جانبی سمی سیس پلاتین را بدون تغییر در اثربخشی آن بهبود بخشد.
برای بررسی بیشتر اثر متفورمین بر سمیت سلولی سیس پلاتین، ما اثر متفورمین را بر آپوپتوز ناشی از سیس پلاتین در سلولهای A2780/CP از طریق آنالیز فلوسایتومتری ارزیابی کردیم. نتایج نشان داد که ترکیب متفورمین با سیس پلاتین بهطور قابلتوجهی آپوپتوز سلولی را در مقایسه با هر عامل بهتنهایی افزایش داد.
در سلولهای سرطانی تخمدان، تفاوت معنیداری در سطح بیان پایه MRP-2 در سلولهای مقاوم A2780/CP و سلولهای حساس A2780 مشاهده نشد، که نشان میدهد مقاومت به سیس پلاتین در سلولهای A2780/CP به دلیل بیان بیشازحد MRP-2 نیست و مکانیسمهای دیگری ممکن است دخیل باشند. علاوه بر بیان بیشازحد پروتئینهای خارج کننده دارو، مکانیسمهای متعدد دیگری مانند افزایشترمیم DNA، تغییرات در مولکولهای هدف، پاسخهای ژنتیکی و آنزیمهای متابولیزهکننده دارو در توسعه MDR دخیل هستند (19-23). بهعنوانمثال، اشاره شده است که سطح پروتئینهای ترمیمکننده DNA مانند xeroderma pigmentosum group E binding factor (XPE-BF) و excision repair cross-complementing protein (ERCC-1) عامل اتصال رنگدانه خشک پوستی گروه E (XPE-BF) و پروتئینهای ترمیمکننده DNA ترمیمکننده متقاطع (ERCC-1) در سلولهای مقاوم به سیس پلاتین و کربوپلاتین افزایش مییابد. مطالعات بیشتر نشان داد که سطح بیان این دو پروتئین ارتباط مستقیمی با مقاومت تومورها به سیس پلاتین و کربوپلاتین دارد (24). در مطالعه اخیر جمالی و همکارانش دریافتند که مقاومت سیس پلاتین با افزایش سطح گلوتاتیون درونسلولی بهعنوان یک عامل سمزدایی در ارتباط است (25). بنابراین، مقاومت سیس پلاتین به نظر میرسد چندعاملی باشد و مکانیسمهای مختلفی ممکن است در مقاومت به سیس پلاتین غیر از MRP-2 دخیل باشد.
مطالعات دیگری همچنین نشان دادهاند که مقاومت به سیس پلاتین با افزایش فعالیت پمپ glutathione-S-conjugate export pump (GS-X pump) و کاهش تجمع سیس پلاتین در داخل سلولهای سرطانی در ارتباط است (26, 27). بنابراین، کاهش محتوای درونسلولی سیس پلاتین در سلولهای A2780/CP پس از تیمار با متفورمین ممکن است منجر به کاهش فعالیت پمپ GS-X و کاهش جریان کونژوگه گلوتاتیون از سلولها و کاهش مقاومت به سیس پلاتین شود.
نتایج مطالعه حاضر نشان داد که تیمار با متفورمین حساسیت سلولهای A2780/CP را به اثرات سیتوتوکسیک سیس پلاتین افزایش میدهد. بنابراین، متفورمین ممکن است یک ترکیب مؤثر و قوی برای درمان ترکیبی در سلولهای سرطان تخمدان و غلبه بر MDR در برابر عوامل شیمیدرمانی باشد. مکانیسم پیشنهادی کاهش مقاومت سلولهای A2780/CP میتواند افزایش گلوتاتیون احیاء داخل سلولی باشد که پیشنهاد میشود در مطالعات آینده تأثیر متفورمین بر میزان گلوتاتیون احیاء داخل سلولی موردبررسی قرار گیرد.
تشکر و قدردانی:
از مرکز تحقیقات سلولهای بنیادی دانشگاه علوم پزشکی تبریز و مرکز تحقیقات سلولی و مولکولی دانشگاه علوم پزشکی ارومیه برای همکاری در این طرح تحقیقاتی تشکر و قدردانی میشود.
حمایت مالی تحقیق:
ندارد.
تضاد منافع:
نویسندگان اعلام میدارند که هیچ تضاد منافع مرتبط با نگارش و یا انتشار این مقاله ندارند.
ملاحظات اخلاقی:
این مطالعه با کد اخلاق IR.TBZMED.REC.1394.795 در کمیته اخلاق دانشگاه علوم پزشکی تبریز به تصویب رسیده است.
متن کامل: (590 مشاهده)
مقدمه
سرطان عامل اصلی مرگومیر و مشکل عمده سلامت در سراسر جهان است و سالانه هزینههای زیادی را برای درمان بیماران و بررسی روشهای جدید تشخیصی و درمانی ایجاد میکند. روشهای معمول برای درمان و مدیریت سرطان که میتواند بهتنهایی یا بهصورت ترکیبی مورداستفاده قرار گیرد شامل جراحی، رادیوتراپی و شیمیدرمانی است (1). سرطان تخمدان یک بدخیمی زنانه است و بیشترین میزان مرگومیر را در بین بدخیمیهای زنان دارد. سالانه بیش از 50 درصد بیماران مبتلا به سرطان تخمدان به دلیل این بیماری جان خود را از دست میدهند (2). سرطان تخمدان به سه زیرگروه تقسیم میشود: تومورهای سلول زایا، استرومایی و اپیتلیال که شایعترین نوع آن، اپیتلیال است (3). درمان استاندارد سرطان تخمدان شامل جراحی و به دنبال آن شیمیدرمانی است. اگرچه اکثر بیماران در مرحله اولیه شیمیدرمانی پاسخ به درمان خوبی دارند، عود تقریباً در 70 درصد بیماران رخ میدهد. بنابراین، ترکیبات جدیدی برای کاهش خطر عود موردنیاز است.
شیمیدرمانی ابزار مهمی برای درمان بسیاری از سرطانها است، بااینحال، موانعی برای شیمیدرمانی موفق وجود دارد (4, 5). علیرغم پیشرفتهایی که در زمینه توسعه داروهای شیمیدرمانی با اثربخشی بالاتر و سمیت کمتر انجام شده است بااینحال، مقاومت در برابر شیمیدرمانی هنوز یک مانع بزرگ در درمان موفقیتآمیز سرطان است. مقاومت در برابر شیمیدرمانی که بهعنوان مقاومت چند دارویی (MDR)[1] شناخته میشود، با مکانیسمهای مختلفی ازجمله افزایش خروج دارو از سلولها از طریق ناقلین متصلشونده به آدنوزین تریفسفات (ABC)[2]، کاهش ورود دارو به سلول، فعال شدن مسیرهای ترمیم DNA، تعدیل مسیرهای آپوپتوز و تغییر در مولکولهای هدف صورت میگیرد (6, 7). در این میان، افزایش جریان دارو توسط ناقلین ABC شایعترین روش برای مقاومت دارویی است. انتقالدهندههای ABC پروتئینهایی هستند که از ATP برای انتقال انواع مختلف ترکیبات در غشاهای بیولوژیکی استفاده میکنند. تا به امروز، 48 نوع از انتقالدهندههای ABC در هفت زیر خانواده مختلف طبقهبندی شدهاند. گلیکو پروتئین-P (P-gp) و پروتئین مقاومت چند دارویی 2 (MRP-2) از رایجترین انتقالدهندههای ABC هستند که در بسیاری از سرطانهای انسانی ازجمله سرطانهای روده بزرگ، پستان و سرطان خون بیان میشوند و طیف گستردهای از عوامل سیتوتوکسیک مانند آلکالوئیدهای وینکا، تاکسانها و آنتراسایکلینها را انتقال میدهند (8-10). یکی از راهبردهای جلوگیری کننده از این اتفاق استفاده از مهارکنندهها مانند وراپامیل و سیکلوسپورین A در ترکیب با داروهای شیمیدرمانی است (11, 12).
مطالعات مختلف نشان دادهاند که داروهای ضد دیابت ازجمله متفورمین، تیازولیدین دیونها و سولفونیل اورهها در صورت ترکیب با عوامل ضد سرطان اثرات مفیدی در درمان سرطان دارند (13, 14). اثرات ضد دیابتی متفورمین با مسدود کردن کمپلکس I زنجیره انتقال الکترون و فسفوریلاسیون اکسیداتیو رخ میدهد که منجر به افزایش نسبت آدنوزین مونوفسفات به آدنوزین تری فسفات میشود. افزایش آدنوزین مونوفسفات میتواند آنزیمهایی مانند آدنیلات سیکلاز، فروکتوز 1،6-بی فسفات و پروتئین کیناز فعال آدنوزین مونو فسفات (AMPK) را تحریک کند که منجر به کاهش گلوکونئوژنز توسط سلولهای کبدی و افزایش حساسیت به انسولین میشود (15, 16). AMPK آنزیم تنظیمکننده کلیدی برای اثرات متابولیک متفورمین است. علاوه بر اثرات متابولیک، AMPK با سیگنالهایی که در رشد سلولی و آپوپتوز نقش دارند تداخل میکند (17). چندین مطالعه پایه و بالینی اثرات مفید متفورمین در درمان سرطان را نشان دادهاند، بااینحال، مکانیسم دقیق مشخص نیست. بنابراین در مطالعه حاضر، هدف ما بررسی اثرات احتمالی متفورمین بر سمیت سلولی سیس پلاتین و بیان ژن MRP-2 و همچنین فعالیت آنها بر روی سلولهای سرطانی تخمدان مقاوم به سیس پلاتین است.
مواد و روش کار
شرایط کشت سلول:
این مطالعه یک مطالعه مداخلهای در سطح in vitro هست. سلولهای حساس سرطان تخمدان A2780 و مقاوم به سیس پلاتین سرطان تخمدان A2780/CP در محیط کشت RPMI-1640 همراه با 10 درصد سرم جنین گاوی[3](FBS)، 1 درصد آنتیبیوتیک، 2 میلی مولار گلوتامین و 1 درصد پیروات سدیم در محیطی با دمای 37 درجه سانتیگراد با 95 درصد رطوبت اتمسفری و حاوی 5 درصد دیاکسید کربن نگهداری شدند.. سلولهای A2780/CP در حضور 2 میکرومولار سیس پلاتین کشت داده شدند و قبل از استفاده در آزمایشها به مدت 1 هفته در محیط کشت عاری از دارو رشد داده شدند.
تست MTT:
برای تجزیهوتحلیل زندهمانی سلول، سنجش MTT انجام شد. بهطور خلاصه، سلولهای A2780/CP و A2780 در سه تکرار در پلیتهای 96 چاهک در محیط کشت RPMI-1640 با 10 درصد FBS با تراکم 104 سلول در هر چاهک کشت داده شدند. پس از 24 ساعت، غلظتهای مختلف سیس پلاتین با و بدون متفورمین در RPMI-1640 حل شد و به هر چاهک اضافه شد. پس از 48 ساعت انکوباسیون، محیط کشت با 200 میکرولیتر محیط تازه حاوی 10 درصد پودر MTT((5mg/ml جایگزین شد و به مدت 4 ساعت دیگر انکوبه شد. سپس محیط خارج شد و فورمازان تشکیل شده در 100 میکرولیتر دی متیل سولفوکساید (DMSO) حل شد. جذب در 570 نانومتر با دستگاه خوانش الایزا (State Fax, 2100, Awareness Technology Inc, Palm City, FL, USA) اندازهگیری شد. زندهمانی سلولها در هر گروه تیمار شده و غلظت مهاری (IC50) محاسبه شد. علاوه بر این، میزان کاهش مقاومت سلولی (RF) با تقسیم IC50 سلولهای مقاوم در هر گروه تیمار شده به IC50 سلولهای نوع حساس محاسبه گردید.
تجزیهوتحلیل سطوح mRNA توسط RT-PCR:
RNA کل 106 × 1 سلول با استفاده از معرف RNX-PLUS طبق دستورالعمل سازنده (سیناژن، تهران، ایران) استخراج شد. سپس 1 میکروگرم از RNA کل برای سنتز cDNA با استفاده از AccuPower PCR PreMix (Bioneer, Korea، Daedeok-gu، Daejeon) استفاده شد. بلافاصله پس از رونویسی معکوس، RT-PCR توسط SYBR Premix Ex Taq (Takara Bio, Otsu, Shiga, Japan) توسط micPCR، (Bio Molecular Systems, Australia) انجام شد. توالی پرایمرهای مورداستفاده در RT-PCR به شرح زیر بود:
سرطان عامل اصلی مرگومیر و مشکل عمده سلامت در سراسر جهان است و سالانه هزینههای زیادی را برای درمان بیماران و بررسی روشهای جدید تشخیصی و درمانی ایجاد میکند. روشهای معمول برای درمان و مدیریت سرطان که میتواند بهتنهایی یا بهصورت ترکیبی مورداستفاده قرار گیرد شامل جراحی، رادیوتراپی و شیمیدرمانی است (1). سرطان تخمدان یک بدخیمی زنانه است و بیشترین میزان مرگومیر را در بین بدخیمیهای زنان دارد. سالانه بیش از 50 درصد بیماران مبتلا به سرطان تخمدان به دلیل این بیماری جان خود را از دست میدهند (2). سرطان تخمدان به سه زیرگروه تقسیم میشود: تومورهای سلول زایا، استرومایی و اپیتلیال که شایعترین نوع آن، اپیتلیال است (3). درمان استاندارد سرطان تخمدان شامل جراحی و به دنبال آن شیمیدرمانی است. اگرچه اکثر بیماران در مرحله اولیه شیمیدرمانی پاسخ به درمان خوبی دارند، عود تقریباً در 70 درصد بیماران رخ میدهد. بنابراین، ترکیبات جدیدی برای کاهش خطر عود موردنیاز است.
شیمیدرمانی ابزار مهمی برای درمان بسیاری از سرطانها است، بااینحال، موانعی برای شیمیدرمانی موفق وجود دارد (4, 5). علیرغم پیشرفتهایی که در زمینه توسعه داروهای شیمیدرمانی با اثربخشی بالاتر و سمیت کمتر انجام شده است بااینحال، مقاومت در برابر شیمیدرمانی هنوز یک مانع بزرگ در درمان موفقیتآمیز سرطان است. مقاومت در برابر شیمیدرمانی که بهعنوان مقاومت چند دارویی (MDR)[1] شناخته میشود، با مکانیسمهای مختلفی ازجمله افزایش خروج دارو از سلولها از طریق ناقلین متصلشونده به آدنوزین تریفسفات (ABC)[2]، کاهش ورود دارو به سلول، فعال شدن مسیرهای ترمیم DNA، تعدیل مسیرهای آپوپتوز و تغییر در مولکولهای هدف صورت میگیرد (6, 7). در این میان، افزایش جریان دارو توسط ناقلین ABC شایعترین روش برای مقاومت دارویی است. انتقالدهندههای ABC پروتئینهایی هستند که از ATP برای انتقال انواع مختلف ترکیبات در غشاهای بیولوژیکی استفاده میکنند. تا به امروز، 48 نوع از انتقالدهندههای ABC در هفت زیر خانواده مختلف طبقهبندی شدهاند. گلیکو پروتئین-P (P-gp) و پروتئین مقاومت چند دارویی 2 (MRP-2) از رایجترین انتقالدهندههای ABC هستند که در بسیاری از سرطانهای انسانی ازجمله سرطانهای روده بزرگ، پستان و سرطان خون بیان میشوند و طیف گستردهای از عوامل سیتوتوکسیک مانند آلکالوئیدهای وینکا، تاکسانها و آنتراسایکلینها را انتقال میدهند (8-10). یکی از راهبردهای جلوگیری کننده از این اتفاق استفاده از مهارکنندهها مانند وراپامیل و سیکلوسپورین A در ترکیب با داروهای شیمیدرمانی است (11, 12).
مطالعات مختلف نشان دادهاند که داروهای ضد دیابت ازجمله متفورمین، تیازولیدین دیونها و سولفونیل اورهها در صورت ترکیب با عوامل ضد سرطان اثرات مفیدی در درمان سرطان دارند (13, 14). اثرات ضد دیابتی متفورمین با مسدود کردن کمپلکس I زنجیره انتقال الکترون و فسفوریلاسیون اکسیداتیو رخ میدهد که منجر به افزایش نسبت آدنوزین مونوفسفات به آدنوزین تری فسفات میشود. افزایش آدنوزین مونوفسفات میتواند آنزیمهایی مانند آدنیلات سیکلاز، فروکتوز 1،6-بی فسفات و پروتئین کیناز فعال آدنوزین مونو فسفات (AMPK) را تحریک کند که منجر به کاهش گلوکونئوژنز توسط سلولهای کبدی و افزایش حساسیت به انسولین میشود (15, 16). AMPK آنزیم تنظیمکننده کلیدی برای اثرات متابولیک متفورمین است. علاوه بر اثرات متابولیک، AMPK با سیگنالهایی که در رشد سلولی و آپوپتوز نقش دارند تداخل میکند (17). چندین مطالعه پایه و بالینی اثرات مفید متفورمین در درمان سرطان را نشان دادهاند، بااینحال، مکانیسم دقیق مشخص نیست. بنابراین در مطالعه حاضر، هدف ما بررسی اثرات احتمالی متفورمین بر سمیت سلولی سیس پلاتین و بیان ژن MRP-2 و همچنین فعالیت آنها بر روی سلولهای سرطانی تخمدان مقاوم به سیس پلاتین است.
مواد و روش کار
شرایط کشت سلول:
این مطالعه یک مطالعه مداخلهای در سطح in vitro هست. سلولهای حساس سرطان تخمدان A2780 و مقاوم به سیس پلاتین سرطان تخمدان A2780/CP در محیط کشت RPMI-1640 همراه با 10 درصد سرم جنین گاوی[3](FBS)، 1 درصد آنتیبیوتیک، 2 میلی مولار گلوتامین و 1 درصد پیروات سدیم در محیطی با دمای 37 درجه سانتیگراد با 95 درصد رطوبت اتمسفری و حاوی 5 درصد دیاکسید کربن نگهداری شدند.. سلولهای A2780/CP در حضور 2 میکرومولار سیس پلاتین کشت داده شدند و قبل از استفاده در آزمایشها به مدت 1 هفته در محیط کشت عاری از دارو رشد داده شدند.
تست MTT:
برای تجزیهوتحلیل زندهمانی سلول، سنجش MTT انجام شد. بهطور خلاصه، سلولهای A2780/CP و A2780 در سه تکرار در پلیتهای 96 چاهک در محیط کشت RPMI-1640 با 10 درصد FBS با تراکم 104 سلول در هر چاهک کشت داده شدند. پس از 24 ساعت، غلظتهای مختلف سیس پلاتین با و بدون متفورمین در RPMI-1640 حل شد و به هر چاهک اضافه شد. پس از 48 ساعت انکوباسیون، محیط کشت با 200 میکرولیتر محیط تازه حاوی 10 درصد پودر MTT((5mg/ml جایگزین شد و به مدت 4 ساعت دیگر انکوبه شد. سپس محیط خارج شد و فورمازان تشکیل شده در 100 میکرولیتر دی متیل سولفوکساید (DMSO) حل شد. جذب در 570 نانومتر با دستگاه خوانش الایزا (State Fax, 2100, Awareness Technology Inc, Palm City, FL, USA) اندازهگیری شد. زندهمانی سلولها در هر گروه تیمار شده و غلظت مهاری (IC50) محاسبه شد. علاوه بر این، میزان کاهش مقاومت سلولی (RF) با تقسیم IC50 سلولهای مقاوم در هر گروه تیمار شده به IC50 سلولهای نوع حساس محاسبه گردید.
تجزیهوتحلیل سطوح mRNA توسط RT-PCR:
RNA کل 106 × 1 سلول با استفاده از معرف RNX-PLUS طبق دستورالعمل سازنده (سیناژن، تهران، ایران) استخراج شد. سپس 1 میکروگرم از RNA کل برای سنتز cDNA با استفاده از AccuPower PCR PreMix (Bioneer, Korea، Daedeok-gu، Daejeon) استفاده شد. بلافاصله پس از رونویسی معکوس، RT-PCR توسط SYBR Premix Ex Taq (Takara Bio, Otsu, Shiga, Japan) توسط micPCR، (Bio Molecular Systems, Australia) انجام شد. توالی پرایمرهای مورداستفاده در RT-PCR به شرح زیر بود:
ABCC2 forward 5’- AGGTTTGCCAGTTATCCGTG -3’, reverse 5’- AACAAAGCCAACAGTGTCCC -3’,
GAPDH forward 5´-TGCACCACCAACTGCTTAGC-3´, reverse 5´-GGCATGGACTGTGGTCATGAG -3 ´
شرایط PCR شامل 95 درجه سانتیگراد به مدت 4 دقیقه و سپس 40 چرخه 95 درجه سانتیگرادی به مدت 10 ثانیه، 60 درجه سانتیگراد به مدت 35 ثانیه و 72 درجه سانتیگراد به مدت 20 ثانیه بود. تمام آزمایشها در سه تکرار انجام شد و برای هر نمونه مقدار آستانه سیکل (Ct) برای ژن هدف و GAPDH بهعنوان ژن مرجع داخلی تعیین شد. سطح بیان mRNA نسبی ژن هدف به سطح بیان GAPDH نرمال شد، که امکان محاسبه cDNA هدف را فراهم کرد.
بررسی آپوپتوز به روش فلوسایتومتری:
اثرات آپوپتوتیک متفورمین بر روی سلولهای A2780/CP با استفاده از کیت ApoFlowEx® FITC (EXBIO Diagnostics، جمهوری چک) انجام شد. سلولها در صفحات 6 چاهکی با تراکم 5 × 105 سلول در هر چاهک کشت داده شدند. پس از 24 ساعت سلولها با سیس پلاتین تنها، ترکیب متفورمین و سیس پلاتین و محیط تازه بهعنوان گروه کنترل تیمار شدند و به مدت 48 ساعت انکوبه شدند. سپس سلولها جدا شدند، دو بار با PBS شسته شدند،
سلولها مجدداً در 500 میکرولیتر از بافر اتصال مخلوط شدند، 5 میکرولیتر Annexin V-FITC و سپس 5 میکرولیتر پروپیدیوم یدید اضافه شد. سلولها به مدت 15 دقیقه در تاریکی انکوبه شدند و با استفاده از دستگاه فلوسایتومتری (FACSCalibur, BD Biosciences, San Jose, CA, USA) آنالیز شدند.
آنالیز آماری:
تمامی دادهها بهصورت میانگین ± انحراف معیار بیان شد و تمام آزمایشها در سه تکرار انجام شد. تجزیهوتحلیل واریانس یکطرفه (ANOVA) برای توضیح تفاوت بین گروهها موردبررسی قرار گرفت. مقادیر P کمتر از 0.05 ازنظر آماری معنیدار در نظر گرفته شد. تمامی دادهها با استفاده از نرمافزار GraphPad Prism 6.01 تجزیهوتحلیل شدند.
یافتهها
تأیید فنوتیپ مقاوم در سلولهای سرطان تخمدان:
سلولهای A2780/CP به سیس پلاتین مقاوم بودند، همانطور که سمیت بالاتر در سلولهای A2780/S تأیید شد. تفاوت قابلتوجهی در بیان ژن MRP-2 در سلولهای A2780 و A2780/CP مشاهده نشد، که نشان میدهد مقاومت در A2780/CP به سیس پلاتین به دلیل بیان بالاتر MRP-2 نیست و مکانیسمهای دیگری ممکن است در سرطان تخمدان نسبت به مقامت به سیس پلاتین دخیل باشند.
متفورمین سمیت سلولی را در سلولهای مقاوم به سیس پلاتین افزایش داد:
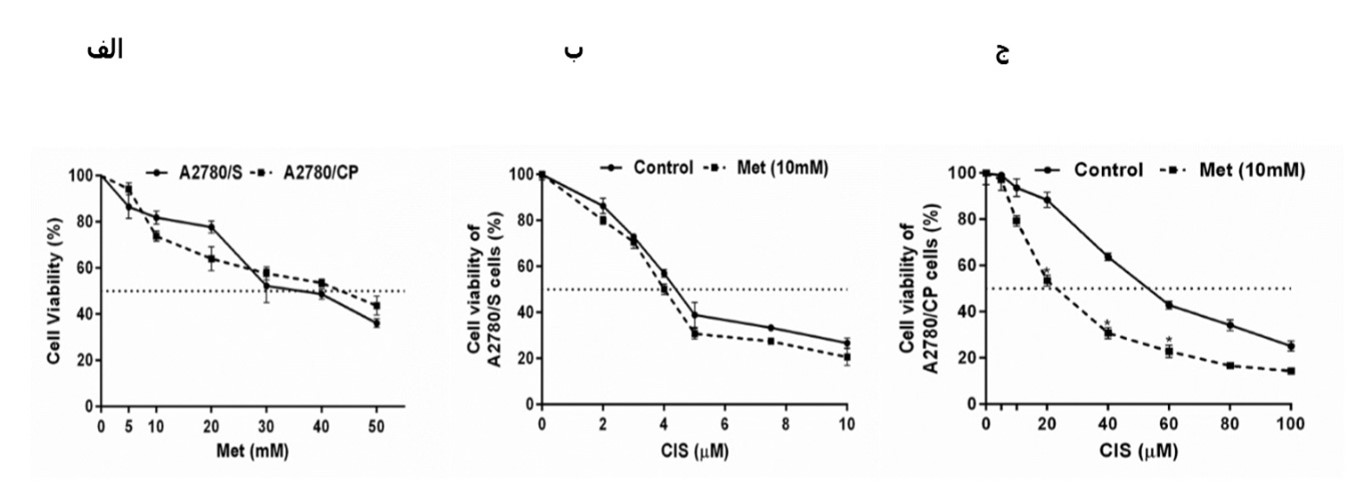
همانطور که در شکل 2 نشان داده شده است، متفورمین سمیت سلولی تقریباً برابری را علیه تمام سلولهای سرطان پستان حساس و مقاوم تیمار شده اعمال کرد. در غلظتهای 5-15 میلیمولار متفورمین اثر بازدارندگی پایینی داشت، درحالیکه اثرات سمی در دوزهای بالاتر از 20 میلیمولار مشاهده شد. انحراف به چپ در پروفایل سمیت سیس پلاتین پس از افزودن متفورمین نشان میدهد که متفورمین سمیت سلولی سیس پلاتین را در سلولهای A2780/CP افزایش میدهد، درحالیکه هیچ تأثیری بر سمیت سلولی سیس پلاتین در سلولهای حساس نداشت. درمان با متفورمین در سلولهای مقاوم بهطور قابلتوجهی مقادیر IC50 سیس پلاتین و RF را کاهش داد، که نشان میدهد متفورمین میتواند MDR را در سلولهای A2780/CP معکوس کند.
.jpg)
شکل (1)- الف- زنده ماندن سلولهای A2780 و A2780/CP پس از تیمار با غلظتهای مختلف سیس پلاتین به مدت 48 ساعت با روش MTT ارزیابی شد. هر نقطه نشاندهنده میانگین ± انحراف معیار سه آزمایش مستقل است. (ب) سطح بیان mRNA ژن MRP-2 در سلولها با استفاده از RT-PCR تعیین و با روش 2 (ΔΔCt) تعیین شد. برای آنالیز آماری ما بین دو گروه از آزمون t test استفاده شد. *(معنیداری (p <0.05

شکل (2)- الف- سمیت سلولی متفورمین در غلظتهای مختلف در سلولهای A2780/S و A2780/CP. (ب، ج) سلولهای A2780/S و A2780/CP با یا بدون 10 میلیمولار متفورمین پس از انکوباسیون با غلظتهای مختلف سیس پلاتین به مدت 48 ساعت تحت تیمار قرار گرفتند. زنده ماندن سلولی با استفاده از روش MTT تعیین شد. هر نقطه نشاندهنده میانگین ± انحراف معیار سه آزمایش مستقل است. *(معنیداری (p <0.05
جدول (1): تأثیر قرار گرفتن در معرض فرمولاسیون متفورمین به همراه سیس پلاتین بر سمیت سلولی در سلولهای A2780 و A2780/CP
جدول (1): تأثیر قرار گرفتن در معرض فرمولاسیون متفورمین به همراه سیس پلاتین بر سمیت سلولی در سلولهای A2780 و A2780/CP
| Cell lines | CIS | CIS+Met (10mM) | ||
| IC50 (μM) | RF | IC50 (μM) | RF | |
| A2780/S | 4.88± 0.37 | - | 4.13± 0.33 | - |
| A2780/CP | 54.52 ± 3.12 | 11.17 | 24.47 ±1.94 | 5* |
پس از تیمار با غلظتهای مختلف سیس پلاتین در فرمولاسیونهای مختلف، زنده ماندن سلولها با استفاده از روش MTT همانطور که در بخش روشها توضیح داده شد، تعیین شد. هر مقدار نشاندهنده میانگین ± انحراف معیار سه آزمایش مستقل است. RF با تقسیم IC50 سلولهای مقاوم در هر گروهدرمانی به IC50 سلولهای نوع حساس محاسبه شد. برای آنالیز آماری ما بین دو گروه از آزمون t test استفاده شد * (معنیداری (p <0.05
میزان بیان MRP-2:
جهت تعیین فنوتیپ مقاوم ما ابتدا میزان بیان پایه ژن MRP-2 را در سلول A2780 و A2780/CP اندازهگیری کردیم. نتایج نشان داد که تفاوت معنیداری در سطح بیان پایه MRP-2 در سلولهای A2780 و A2780/CP وجود نداشت، این یافتهها نشان میدهند که مقاومت به سیس پلاتین در سلولهای مقاوم به سیس پلاتین A2780/CP به دلیل بیان بالاتر MRP-2 نیست و احتمالاً مکانیسمهای دیگری در مقاومت به سیس پلاتین در این سلولها دخالت دارند (شکل 2).
میزان آپوپتوز سلولهای سرطان تخمدان:
برای تعیین اثرات درمان با متفورمین بر آپوپتوز ناشی از سیس پلاتین، روش رنگآمیزی Annexin V/PI انجام شد. نتایج فلوسایتومتری نشان داد که متفورمین در ترکیب با سیس پلاتین بهطور قابلتوجهی میزان آپوپتوز در سلولهای A2780/CP را در مقایسه با سلولهایی که دارو را بهتنهایی دریافت کرده بودند افزایش میدهد (شکل 3).
میزان بیان MRP-2:
جهت تعیین فنوتیپ مقاوم ما ابتدا میزان بیان پایه ژن MRP-2 را در سلول A2780 و A2780/CP اندازهگیری کردیم. نتایج نشان داد که تفاوت معنیداری در سطح بیان پایه MRP-2 در سلولهای A2780 و A2780/CP وجود نداشت، این یافتهها نشان میدهند که مقاومت به سیس پلاتین در سلولهای مقاوم به سیس پلاتین A2780/CP به دلیل بیان بالاتر MRP-2 نیست و احتمالاً مکانیسمهای دیگری در مقاومت به سیس پلاتین در این سلولها دخالت دارند (شکل 2).
میزان آپوپتوز سلولهای سرطان تخمدان:
برای تعیین اثرات درمان با متفورمین بر آپوپتوز ناشی از سیس پلاتین، روش رنگآمیزی Annexin V/PI انجام شد. نتایج فلوسایتومتری نشان داد که متفورمین در ترکیب با سیس پلاتین بهطور قابلتوجهی میزان آپوپتوز در سلولهای A2780/CP را در مقایسه با سلولهایی که دارو را بهتنهایی دریافت کرده بودند افزایش میدهد (شکل 3).

شکل (3): تجزیهوتحلیل فلوسایتومتری آپوپتوز سلولهای A2780/CP. سلولهای A2780/CP با سیس پلاتین (24 میکرومولار) و متفورمین (10 میلی مولار) تیمار شدند. پس از 48 ساعت انکوباسیون، سلولها با Annexin V و PI رنگآمیزی شدند.
بحث و نتیجهگیری
اگرچه سیس پلاتین جزء ترکیبات ضد سرطانی قوی و پرکاربردی هست، درمان با این دارو با عوارض جانبی شدید بهویژه سمیت کلیوی همراه است که بیشتر به غلظت دارو بستگی دارد (18). برای کاهش عوارض جانبی سمی سیس پلاتین یک رویکرد استفاده همزمان آن با ترکیبات بیخطر و با عوارض جانبی کم هست. در این مطالعه مشاهده کردیم که ترکیب متفورمین در غلظتهای غیر سمی با سیس پلاتین، IC50 را در سلولهای A2780/CP کاهش داد، که نشان میدهد متفورمین ممکن است عوارض جانبی سمی سیس پلاتین را بدون تغییر در اثربخشی آن بهبود بخشد.
برای بررسی بیشتر اثر متفورمین بر سمیت سلولی سیس پلاتین، ما اثر متفورمین را بر آپوپتوز ناشی از سیس پلاتین در سلولهای A2780/CP از طریق آنالیز فلوسایتومتری ارزیابی کردیم. نتایج نشان داد که ترکیب متفورمین با سیس پلاتین بهطور قابلتوجهی آپوپتوز سلولی را در مقایسه با هر عامل بهتنهایی افزایش داد.
در سلولهای سرطانی تخمدان، تفاوت معنیداری در سطح بیان پایه MRP-2 در سلولهای مقاوم A2780/CP و سلولهای حساس A2780 مشاهده نشد، که نشان میدهد مقاومت به سیس پلاتین در سلولهای A2780/CP به دلیل بیان بیشازحد MRP-2 نیست و مکانیسمهای دیگری ممکن است دخیل باشند. علاوه بر بیان بیشازحد پروتئینهای خارج کننده دارو، مکانیسمهای متعدد دیگری مانند افزایشترمیم DNA، تغییرات در مولکولهای هدف، پاسخهای ژنتیکی و آنزیمهای متابولیزهکننده دارو در توسعه MDR دخیل هستند (19-23). بهعنوانمثال، اشاره شده است که سطح پروتئینهای ترمیمکننده DNA مانند xeroderma pigmentosum group E binding factor (XPE-BF) و excision repair cross-complementing protein (ERCC-1) عامل اتصال رنگدانه خشک پوستی گروه E (XPE-BF) و پروتئینهای ترمیمکننده DNA ترمیمکننده متقاطع (ERCC-1) در سلولهای مقاوم به سیس پلاتین و کربوپلاتین افزایش مییابد. مطالعات بیشتر نشان داد که سطح بیان این دو پروتئین ارتباط مستقیمی با مقاومت تومورها به سیس پلاتین و کربوپلاتین دارد (24). در مطالعه اخیر جمالی و همکارانش دریافتند که مقاومت سیس پلاتین با افزایش سطح گلوتاتیون درونسلولی بهعنوان یک عامل سمزدایی در ارتباط است (25). بنابراین، مقاومت سیس پلاتین به نظر میرسد چندعاملی باشد و مکانیسمهای مختلفی ممکن است در مقاومت به سیس پلاتین غیر از MRP-2 دخیل باشد.
مطالعات دیگری همچنین نشان دادهاند که مقاومت به سیس پلاتین با افزایش فعالیت پمپ glutathione-S-conjugate export pump (GS-X pump) و کاهش تجمع سیس پلاتین در داخل سلولهای سرطانی در ارتباط است (26, 27). بنابراین، کاهش محتوای درونسلولی سیس پلاتین در سلولهای A2780/CP پس از تیمار با متفورمین ممکن است منجر به کاهش فعالیت پمپ GS-X و کاهش جریان کونژوگه گلوتاتیون از سلولها و کاهش مقاومت به سیس پلاتین شود.
نتایج مطالعه حاضر نشان داد که تیمار با متفورمین حساسیت سلولهای A2780/CP را به اثرات سیتوتوکسیک سیس پلاتین افزایش میدهد. بنابراین، متفورمین ممکن است یک ترکیب مؤثر و قوی برای درمان ترکیبی در سلولهای سرطان تخمدان و غلبه بر MDR در برابر عوامل شیمیدرمانی باشد. مکانیسم پیشنهادی کاهش مقاومت سلولهای A2780/CP میتواند افزایش گلوتاتیون احیاء داخل سلولی باشد که پیشنهاد میشود در مطالعات آینده تأثیر متفورمین بر میزان گلوتاتیون احیاء داخل سلولی موردبررسی قرار گیرد.
تشکر و قدردانی:
از مرکز تحقیقات سلولهای بنیادی دانشگاه علوم پزشکی تبریز و مرکز تحقیقات سلولی و مولکولی دانشگاه علوم پزشکی ارومیه برای همکاری در این طرح تحقیقاتی تشکر و قدردانی میشود.
حمایت مالی تحقیق:
ندارد.
تضاد منافع:
نویسندگان اعلام میدارند که هیچ تضاد منافع مرتبط با نگارش و یا انتشار این مقاله ندارند.
ملاحظات اخلاقی:
این مطالعه با کد اخلاق IR.TBZMED.REC.1394.795 در کمیته اخلاق دانشگاه علوم پزشکی تبریز به تصویب رسیده است.
نوع مطالعه: پژوهشي(توصیفی- تحلیلی) |
موضوع مقاله:
فارماکولوژی
فهرست منابع
1. Siegel R, DeSantis C, Virgo K, Stein K, Mariotto A, Smith T, Cooper D, Gansler T, Lerro C, Fedewa S, Lin C, Leach C, Cannady RS, Cho H, Scoppa S, Hachey M, Kirch R, Jemal A, Ward E. Cancer treatment and survivorship statistics, 2012. Cancer J Clin 2012;62(4):220-41. [DOI:10.3322/caac.21149] [PMID]
2. Morrison J, Haldar K, Kehoe S, Lawrie TA. Chemotherapy versus surgery for initial treatment in advanced ovarian epithelial cancer. Cochrane Database Syst Rev 2012;2012(8):Cd005343. [DOI:10.1002/14651858.CD005343.pub3]
3. Ozols RF. Treatment goals in ovarian cancer. Int J Gynecol Cancer 2005;15 Suppl 1:3-11. [DOI:10.1136/ijgc-00009577-200505001-00002] [PMID]
4. Ambudkar SV, Dey S, Hrycyna CA, Ramachandra M, Pastan I, Gottesman MM. Biochemical, cellular, and pharmacological aspects of the multidrug transporter. Annu Rev Pharmacol Toxicol 1999;39:361-98. [DOI:10.1146/annurev.pharmtox.39.1.361] [PMID]
5. Krishna R, Mayer LD. Multidrug resistance (MDR) in cancer. Mechanisms, reversal using modulators of MDR and the role of MDR modulators in influencing the pharmacokinetics of anticancer drugs. Eur J Pharm Sci 2000;11(4):265-83. [DOI:10.1016/S0928-0987(00)00114-7] [PMID]
6. Gottesman MM, Ambudkar SV. Overview: ABC transporters and human disease. J Bioenerg Biomembr 2001;33(6):453-8. [DOI:10.1023/A:1012866803188] [PMID]
7. Yousefi B, Samadi N, Baradaran B, Shafiei-Irannejad V, Zarghami N. Peroxisome Proliferator-Activated Receptor Ligands and Their Role in Chronic Myeloid Leukemia: Therapeutic Strategies. Chem Biol Drug Des 2016;88(1):17-25. [DOI:10.1111/cbdd.12737] [PMID]
8. Juliano RL, Ling V. A surface glycoprotein modulating drug permeability in Chinese hamster ovary cell mutants. Biochim Biophys Acta 1976;455(1):152-62. [DOI:10.1016/0005-2736(76)90160-7]
9. Kartner N, Riordan JR, Ling V. Cell surface P-glycoprotein associated with multidrug resistance in mammalian cell lines. Science 1983;221(4617):1285-8. [DOI:10.1126/science.6137059] [PMID]
10. Goldstein LJ, Galski H, Fojo A, Willingham M, Lai SL, Gazdar A, Pirker R, Green A, Crist W, Brodeur GM, et al. Expression of a multidrug resistance gene in human cancers. J Natl Cancer Inst 1989;81(2):116-24. [DOI:10.1093/jnci/81.2.116] [PMID]
11. Gottesman MM, Ling V. The molecular basis of multidrug resistance in cancer: the early years of P-glycoprotein research. FEBS Lett 2006;580(4):998-1009. [DOI:10.1016/j.febslet.2005.12.060] [PMID]
12. Zhang Z, Tan S, Feng SS. Vitamin E TPGS as a molecular biomaterial for drug delivery. Biomaterials 2012;33(19):4889-906. [DOI:10.1016/j.biomaterials.2012.03.046] [PMID]
13. Edgerton DS, Johnson KM, Cherrington AD. Current strategies for the inhibition of hepatic glucose production in type 2 diabetes. Front Biosci 2009;14(3):1169-81. [DOI:10.2741/3301] [PMID]
14. Bikman BT, Zheng D, Kane DA, Anderson EJ, Woodlief TL, Price JW, Dohm GL, Neufer PD, Cortright RN. Metformin Improves Insulin Signaling in Obese Rats via Reduced IKKbeta Action in a Fiber-Type Specific Manner. J Obes 2010;2010. [DOI:10.1155/2010/970865] [PMID] []
15. Zheng J, Woo SL, Hu X, Botchlett R, Chen L, Huo Y, Wu C. Metformin and metabolic diseases: a focus on hepatic aspects. Front Med 2015;9(2):173-86. [DOI:10.1007/s11684-015-0384-0] [PMID] []
16. Lee JM, Seo WY, Song KH, Chanda D, Kim YD, Kim DK, Lee MW, Ryu D, Kim YH, Noh JR, Lee CH, Chiang JY, Koo SH, Choi HS. AMPK-dependent repression of hepatic gluconeogenesis via disruption of CREB.CRTC2 complex by orphan nuclear receptor small heterodimer partner. J Biol Chem 2010;285(42):32182-91. [DOI:10.1074/jbc.M110.134890] [PMID] []
17. Pierotti MA, Berrino F, Gariboldi M, Melani C, Mogavero A, Negri T, Pasanisi P, Pilotti S. Targeting metabolism for cancer treatment and prevention: metformin, an old drug with multi-faceted effects. Oncogene. 2013;32(12):1475-87. [DOI:10.1038/onc.2012.181] [PMID]
18. McGowan JV, Chung R, Maulik A, Piotrowska I, Walker JM, Yellon DM. Anthracycline Chemotherapy and Cardiotoxicity. Cardiovasc Drugs Ther 2017;31(1):63-75. PMC5346598. 10.1007/s10557-016-6711-0 [DOI:10.1007/s10557-016-6711-0] [PMID] []
19. Hartwell LH, Szankasi P, Roberts CJ, Murray AW, Friend SH. Integrating genetic approaches into the discovery of anticancer drugs. Science 1997;278(5340):1064-8. [DOI:10.1126/science.278.5340.1064] [PMID]
20. Burger H, Foekens JA, Look MP, Meijer-van Gelder ME, Klijn JG, Wiemer EA, Stoter G, Nooter K. RNA expression of breast cancer resistance protein, lung resistance-related protein, multidrug resistance-associated proteins 1 and 2, and multidrug resistance gene 1 in breast cancer: correlation with chemotherapeutic response. Clin Cancer Res 2003;9(2):827-36.
21. Bardin A, Boulle N, Lazennec G, Vignon F, Pujol P. Loss of ERbeta expression as a common step in estrogen-dependent tumor progression. Endocr Relat Cancer 2004;11(3):537-51. [DOI:10.1677/erc.1.00800] [PMID] []
22. Welcsh PL, King MC. BRCA1 and BRCA2 and the genetics of breast and ovarian cancer. Hum Mol Genet 2001;10(7):705-13. [DOI:10.1093/hmg/10.7.705] [PMID]
23. Urquhart BL, Tirona RG, Kim RB. Nuclear receptors and the regulation of drug-metabolizing enzymes and drug transporters: implications for interindividual variability in response to drugs. J Clin Pharmacol 2007;47(5):566-78. [DOI:10.1177/0091270007299930] [PMID]
24. Stewart DJ. Mechanisms of resistance to cisplatin and carboplatin. Crit Rev Oncol Hematol 2007;63(1):12-31. [DOI:10.1016/j.critrevonc.2007.02.001] [PMID]
25. Jamali B, Nakhjavani M, Hosseinzadeh L, Amidi S, Nikounezhad N, F HS. Intracellular GSH Alterations and Its Relationship to Level of Resistance following Exposure to Cisplatin in Cancer Cells. Iran J Pharm Res 2015;14(2):513-9.
26. Kurokawa H, Nishio K, Ishida T, Arioka H, Fukuoka K, Nomoto T, Fukumoto H, Yokote H, Saijo N. Effect of glutathione depletion on cisplatin resistance in cancer cells transfected with the gamma-glutamylcysteine synthetase gene. Jpn J Cancer Res 1997;88(2):108-10. [DOI:10.1111/j.1349-7006.1997.tb00354.x] [PMID] []
27. Oguri T, Isobe T, Suzuki T, Nishio K, Fujiwara Y, Katoh O, Yamakido M. Increased expression of the MRP5 gene is associated with exposure to platinum drugs in lung cancer. Int J Cancer 2000;86(1):95-100. https://doi.org/10.1002/(SICI)1097-0215(20000401)86:1<95::AID-IJC15>3.0.CO;2-G
https://doi.org/10.1002/(SICI)1097-0215(20000401)86:1<95::AID-IJC15>3.0.CO;2-G [DOI:10.1002/(SICI)1097-0215(20000401)86:13.0.CO;2-G]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







