دوره 34، شماره 6 - ( شهریور 1402 )
جلد 34 شماره 6 صفحات 320-308 |
برگشت به فهرست نسخه ها
Ethics code: IR-UU-AEC-3/5
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Zeinali Z, Abtahi Froushani S M, Ownagh A, Zamani A. THE SYNERGISM OF THE COMBINED GLYCYRRHIZIC ACID AND ALUM LIPOSOME ON IMMUNE RESPONSES AGAINST THE KILLED FORM OF SALMONELLA TYPHIMURIUM. Studies in Medical Sciences 2023; 34 (6) :308-320
URL: http://umj.umsu.ac.ir/article-1-5994-fa.html
URL: http://umj.umsu.ac.ir/article-1-5994-fa.html
زینالی زهرا، ابطحی فروشانی سیدمیثم، اونق عبدالغفار، زمانی اصغر. همافزایی ترکیب لیپوزم گلایسریزیک اسید و آلوم بر پاسخهای ایمنی علیه شکل کشتهشده سالمونلا تیفی موریوم. مجله مطالعات علوم پزشکی. 1402; 34 (6) :308-320
دانشیار ایمونولوژی، گروه میکروبیولوژی، دانشکده دامپزشکی دانشگاه ارومیه، ارومیه، ایران (نویسنده مسئول) ، sm.abtahi@hotmail.com
متن کامل [PDF 859 kb]
(398 دریافت)
| چکیده (HTML) (1176 مشاهده)
.jpg)
.jpg)
نمودار (3): تأثیر ادواجنتها بر روی شدت تکثیر لنفوسیتهای طحالی
.jpg)
نمودار (4): اثرات واکسیناسیون بر پاسخ آنتیبادی
.PNG)
همانطور که انتظار میرفت، با توجه به نتایج ذکرشده در بالا، بیشترین درصد بقای موشها پس از دریافت دوز کشنده S. typhimurium زنده متعلق به گروه HKST/GL/A بود (نمودار 6). در این گروه پس از سه هفته 67 درصد موشها زنده بودند. در گروه دریافتکننده واکسنهای HKST/GL هیچکدام از موشها طی
هفته دوم پس از تلقیح با باکتریهای زنده در دوز کشنده زنده نبودند (نمودار 6). تنها یک موش در گروه دریافتکننده آلوم و شکل کشتهشده باکتری توانست که یک هفته زنده بماند. تمام موشهای گروه HKST پس از چالش با باکتری زنده تا روز 5 تلف شدند. این عدد برای موشهای گروه غیر واکسینه تنها دو روز بود (نمودار 6).
.jpg)
نمودار (6): میزان بقای موشها پس از چالش با S. typhimurium زنده
تشکر و قدردانی
متن کامل: (273 مشاهده)
مقدمه
اگرچه واکسنها بهطور قابلتوجهی مرگومیر و عوارض ناشی از عوامل عفونی را در انسان و حیوانات کاهش دادهاند، اما هیچ واکسن مناسبی علیه برخی از پاتوژنها وجود ندارد. یک پاسخ ایمنی مناسب در برابر بیشتر پاتوژنها شامل ترکیبی از پاسخهای ایمنی سلولی و هومورال است (1, 2). پاسخ هر دو بازوی ایمنی در عفونتهای داخل سلولی مانند عفونتهای سالمونلا لازم است. ایمنی هومورال مناسب از استقرار عفونت پیشگیری میکند، درحالیکه ایمنی سلولی پس از استقرار عفونت و ورود میکروب به داخل سلولها وارد عمل میشود (2, 3).
در نگاه اول، بهمنظور ایجاد پاسخهای ایمنی سلولی مناسب در برابر میکروبهای درونسلولی اختیاری یا اجباری، استفاده از نوعی از این میکروارگانیسمها با حدت ضعیف شده منطقی به نظر میرسد. بااینحال، این شکل از میکروارگانیسم همیشه در دسترس نیست. علاوه بر این، ترکیب اشکال کشتهشده میکروارگانیسمها و ادجوانتهای متداول از قبیل آلوم عمدتاً تنها پاسخهای ایمنی هومورال را ایجاد میکنند (4-6). بنابراین، یک راهحل مناسب، طراحی انواع جدیدی از ادجوانت است که در ترکیب با شکل کشتهشده پاتوژنها، یک پاسخ ایمنی سلولی نیز ایجاد کند.
بسیاری از ادجوانتهایی که در مدلهای حیوانی ایمنی سلولی ایجاد کردهاند، برای انسان به دلیل سمیت یا قیمت فوقالعاده بالا قابلاستفاده نیستند. بهعنوانمثال، استفاده از ادجوانت کامل فروند، بهعنوان یکی از قویترین عوامل در تحریک ایمنی سلولی و پاسخهای Th1، به دلیل سمیت بالا، القای واکنشهای مرتبط با درد شدید، تنها به استفاده در حیوانات آزمایشگاهی محدود شده است (7, 8). ساپونینها گروه ناهمگنی از استرول و تری ترپن گلیکوزیدها هستند که از طیف وسیعی از گیاهان جدا شدهاند (9). با توجه به اینکه ساپونینها قدرت تحریک سیستم ایمنی حیوانات را دارند، علاقه زیادی نسبت به استفاده از آنها بهعنوان ادجوانت ایجاد شده است (10). گلایسیریزیک اسید یا گلایسرین یک ساپونین تریترپنوئیدی استخراجشده از گیاه شیرینبیان هست. این ماده دارای خواص شناختهشدهای از قبیل اثرات بهبوددهنده زخم، ضد سرفه، ضدویروس و القاگر تولید اینترفرون است (10, 11). ولی در استفاده از این ماده مشکلاتی از قبیل حلالیت کم وجود دارد. یکی از راهکارهای فائق آمدن بر این مسئله واردکردن گلایسریزیک اسید به لیپوزوم جهت افزایش رسانش آن است (10).
در نگاه اول، بهمنظور ایجاد پاسخهای ایمنی سلولی مناسب در برابر میکروبهای درونسلولی اختیاری یا اجباری، استفاده از نوعی از این میکروارگانیسمها با حدت ضعیف شده منطقی به نظر میرسد. بااینحال، این شکل از میکروارگانیسم همیشه در دسترس نیست. علاوه بر این، ترکیب اشکال کشتهشده میکروارگانیسمها و ادجوانتهای متداول از قبیل آلوم عمدتاً تنها پاسخهای ایمنی هومورال را ایجاد میکنند (4-6). بنابراین، یک راهحل مناسب، طراحی انواع جدیدی از ادجوانت است که در ترکیب با شکل کشتهشده پاتوژنها، یک پاسخ ایمنی سلولی نیز ایجاد کند.
بسیاری از ادجوانتهایی که در مدلهای حیوانی ایمنی سلولی ایجاد کردهاند، برای انسان به دلیل سمیت یا قیمت فوقالعاده بالا قابلاستفاده نیستند. بهعنوانمثال، استفاده از ادجوانت کامل فروند، بهعنوان یکی از قویترین عوامل در تحریک ایمنی سلولی و پاسخهای Th1، به دلیل سمیت بالا، القای واکنشهای مرتبط با درد شدید، تنها به استفاده در حیوانات آزمایشگاهی محدود شده است (7, 8). ساپونینها گروه ناهمگنی از استرول و تری ترپن گلیکوزیدها هستند که از طیف وسیعی از گیاهان جدا شدهاند (9). با توجه به اینکه ساپونینها قدرت تحریک سیستم ایمنی حیوانات را دارند، علاقه زیادی نسبت به استفاده از آنها بهعنوان ادجوانت ایجاد شده است (10). گلایسیریزیک اسید یا گلایسرین یک ساپونین تریترپنوئیدی استخراجشده از گیاه شیرینبیان هست. این ماده دارای خواص شناختهشدهای از قبیل اثرات بهبوددهنده زخم، ضد سرفه، ضدویروس و القاگر تولید اینترفرون است (10, 11). ولی در استفاده از این ماده مشکلاتی از قبیل حلالیت کم وجود دارد. یکی از راهکارهای فائق آمدن بر این مسئله واردکردن گلایسریزیک اسید به لیپوزوم جهت افزایش رسانش آن است (10).
لیپوزومها وزیکولهای دولایهای هستند که پس از توزیع آمفیفیلها ) دوگانه دوستها) در محیطهای آبی بهطور خودبهخود تشکیل میشوند. آمفیفیلها معمولاً فسفولیپید هستند و از رایجترین اجزای آن فسفاتیدیل کولین و فسفاتیدیل گلیسرول هستند. مواد دیگری مانند کلسترول اغلب در فرمولاسیون گنجانده میشوند. ترکیبات آبدوست را میتوان در داخل لیپوزوم به دام انداخت، درحالیکه ترکیبات چربی دوست معمولاً در غشای لیپوزوم گنجانده میشوند (12). لیپوزوم به دلیل استفاده بالقوه و واقعی خود در دارورسانی هدفمند شناخته شدهاند (13). علاوه بر این، به نظر میرسد لیپوزوم دارای مزایای بسیاری مانند ارزانقیمت بودن، پایداری بالا، زیستتخریبپذیر بودن به همراه توانمندی تحریک پاسخهای ایمنی با واسطه هومورال و سلولی هستند (14, 15).
در این مطالعه بهعنوان یک هدف فرعی، تأثیر لیپوزوم گلایسریزیک اسید GL)) بر پاسخهای ایمنی سلولی و همورال بر موشهای Balb/c ایمن شده با شکل کشتهشده سالمونلا تیفی موریوم (HKST) سنجیده شد. همچنین بهعنوان هدف اصلی تأثیر ترکیب آلوم و GL بر القای پاسخهای ایمنی سلولی و هومورال در پاسخ به HKST در موشهای Balb/c سنجیده شد.
مواد و روش کار
در این مطالعه بهعنوان یک هدف فرعی، تأثیر لیپوزوم گلایسریزیک اسید GL)) بر پاسخهای ایمنی سلولی و همورال بر موشهای Balb/c ایمن شده با شکل کشتهشده سالمونلا تیفی موریوم (HKST) سنجیده شد. همچنین بهعنوان هدف اصلی تأثیر ترکیب آلوم و GL بر القای پاسخهای ایمنی سلولی و هومورال در پاسخ به HKST در موشهای Balb/c سنجیده شد.
مواد و روش کار
مواد: لیسیتین سویا، کلسترول، ساکاروز، محیط بلاد آگار، محیط کشت RPMI-1640، سرم جنین گاوی (FBS) و گلیسیریزیک اسید از شرکت Biowest-آلمان خریداری شد. دی متیل سولفوکساید (DMSO)، 3-(4،5-دی متیل تیازول-2-ایل)-2،5-دی متیل تترازولیوم بروماید (MTT)، و ترشیوبوتیل الکل از شرکت MilliporeSigma – آلمان تهیه شد.
طراحی پژوهش و جامعه موردمطالعه: این پژوهش از نوع تجربی بوده است که بهصورت موردی-شاهدی انجام شده است. جامعه موردمطالعه شامل موشهای نر Balb/c شش تا هشتهفتهای بود که از مرکز حیوانات دانشکده داروسازی دانشگاه ارومیه خریداری شده بودند. ملاحظات اخلاقی در مورد آزمایش بر روی حیوانات به دنبال کنوانسیون هلسینکی در نظر گرفته شد و این مطالعه توسط کمیته اخلاق دانشکده دامپزشکی دانشگاه ارومیه (کد IR-UU-AEC-3/5) تأیید شد.
پس از گذشت یک هفته جهت تطابق، موشها به پنج گروه تقسیم شدند. هر گروه شامل 25 موش بود. موشها با حجم 150 میکرولیتر، دو بار با فاصله 14 روز بهصورت زیر جلدی واکسینه شدند. تمام تزریقات زیر جلدی به روی پوست شل روی گردن طبق جدول زیر انجام شد.
طراحی پژوهش و جامعه موردمطالعه: این پژوهش از نوع تجربی بوده است که بهصورت موردی-شاهدی انجام شده است. جامعه موردمطالعه شامل موشهای نر Balb/c شش تا هشتهفتهای بود که از مرکز حیوانات دانشکده داروسازی دانشگاه ارومیه خریداری شده بودند. ملاحظات اخلاقی در مورد آزمایش بر روی حیوانات به دنبال کنوانسیون هلسینکی در نظر گرفته شد و این مطالعه توسط کمیته اخلاق دانشکده دامپزشکی دانشگاه ارومیه (کد IR-UU-AEC-3/5) تأیید شد.
پس از گذشت یک هفته جهت تطابق، موشها به پنج گروه تقسیم شدند. هر گروه شامل 25 موش بود. موشها با حجم 150 میکرولیتر، دو بار با فاصله 14 روز بهصورت زیر جلدی واکسینه شدند. تمام تزریقات زیر جلدی به روی پوست شل روی گردن طبق جدول زیر انجام شد.
جدول (1): گروهبندی و ترکیبات تزریقشده هر گروه
| گروه | آلوم | لیپوزوم حاوی گلایسیریزیک اسید mg/kg)20) | PBS[1] | باکتری کشتهشده (CFU 106 به ازای هر موش) |
| کنترل | - | - | µl250 | - |
| باکتری کشتهشده (HKST) | µl50 | - | µl200 | µl50 |
| آلوم +باکتری کشتهشده (HKST/A) | - | - | µl150 | µl50 |
| لیپوزوم گلایسریزیک اسید +باکتری کشتهشده (HKST/GL) | - | µl50 | µl150 | µl50 |
| آلوم+لیپوزوم گلایسریزیک اسید +باکتری کشتهشده (HKST/GL/A) | µl50 | µl50 | µl150 | µl50 |
تهیه شکل کشتهشده باکتری سالمونلا تیفی موریوم (HKST): سوش استاندارد باکتری سالمونلا تیفی موریوم از کلکسیون باکتریایی آزمایشگاه بهداشت مواد غذایی دانشگاه ارومیه (ATCC14028) به مدت یک شبانهروز در محیط بلاد آگار در 37 درجه سانتیگراد کشت داده شد. کلنیهای باکتری برداشتشده و 3 بار در PBS شسته شد و سپس در℃ 80 به مدت 2 ساعت انکوبه گردید. پس از اطمینان عدم رشد باکتریها، در محیط بلاد آگار، غلظت سوسپانسون باکتری به روش نیمه مک فارند مشخص شد (3).
تهیه میسلهای حاوی اسیدگلایسیریزیک (GA): ساخت لیپوزوم به روش Dehydration/Rehydration صورت گرفت. برای این منظور دو فاز آبی و آلی بهصورت جداگانه تهیه و بهصورت زیر مخلوط شدند (نسبت حجمی فاز آلی: آبی = 45:55) تا محلولی یکنواخت با حجم نهایی به دست آید. 4/7 میلیلیتر: فاز آلی: 40 میلیگرم لسیتین سویا ((SPC) 10 میلیگرم کلسترول در حجم 2/6 میلیلیتر ترشیو بوتیل الکل در دمای 45 درجه سانتیگراد حل شد. فاز آبی: پنج میلیگرم GA و 120 میلیگرم ساکارز در 1/2 میلیلیتر آب دیونیزه در دمای 45 درجه سانتیگراد حل شد. محلول بهدستآمده لیوفیلیز شده و پودر سفیدرنگی به دست آمد و مجدداً در 7/4 میلیلیتر آب دیونیزه شده در دمای 65 درجه سانتیگراد پراکنده شد (10).
ارزیابی حساسیت ازدیاد نوع تأخیری (DTH): 14 روز پس از آخرین ایمنسازی، تعداد یکمیلیون باکتری کشتهشده سالمونلا تیفی موریوم بهصورت زیر جلدی به بالشتک کفپایی سمت چپ 5 موش از هر گروه تزریق شد. همان حجم نرمال سالین بهعنوان کنترل منفی به کف پای راست هر موش تزریق شد. پس از 48 ساعت، ضخامت بالشک پا توسط کولیس دیجیتال بررسی شد. میزان DTH بر اساس این فرمول محاسبه شد:
[(ضخامت پای راست) _ (ضخامت پای چپ] * 100/ (ضخامت پای چپ)
ارزیابیهای ایمونولوژیک: 14 روز پس از آخرین ایمنسازی، پنج موش در هر گروه با استفاده تزریق داخل صفاقی کتامین (mg/kg100) و زایلازین (mg/kg 10) تحت بیهوشی عمیق قرار گرفتند. ابتدا از موشهای و همچنین موشهای گروه شاهد نمونه خونگرفته شد و سرم آنها جدا شد. تیتر اختصاصی IgG در برابر HKST و نسبت IgG2b/IgG1 سپس با استفاده از روش ELISA طبق روش کاری که در گذشته شرح شده، بررسی شد (3, 16).
تهیه میسلهای حاوی اسیدگلایسیریزیک (GA): ساخت لیپوزوم به روش Dehydration/Rehydration صورت گرفت. برای این منظور دو فاز آبی و آلی بهصورت جداگانه تهیه و بهصورت زیر مخلوط شدند (نسبت حجمی فاز آلی: آبی = 45:55) تا محلولی یکنواخت با حجم نهایی به دست آید. 4/7 میلیلیتر: فاز آلی: 40 میلیگرم لسیتین سویا ((SPC) 10 میلیگرم کلسترول در حجم 2/6 میلیلیتر ترشیو بوتیل الکل در دمای 45 درجه سانتیگراد حل شد. فاز آبی: پنج میلیگرم GA و 120 میلیگرم ساکارز در 1/2 میلیلیتر آب دیونیزه در دمای 45 درجه سانتیگراد حل شد. محلول بهدستآمده لیوفیلیز شده و پودر سفیدرنگی به دست آمد و مجدداً در 7/4 میلیلیتر آب دیونیزه شده در دمای 65 درجه سانتیگراد پراکنده شد (10).
ارزیابی حساسیت ازدیاد نوع تأخیری (DTH): 14 روز پس از آخرین ایمنسازی، تعداد یکمیلیون باکتری کشتهشده سالمونلا تیفی موریوم بهصورت زیر جلدی به بالشتک کفپایی سمت چپ 5 موش از هر گروه تزریق شد. همان حجم نرمال سالین بهعنوان کنترل منفی به کف پای راست هر موش تزریق شد. پس از 48 ساعت، ضخامت بالشک پا توسط کولیس دیجیتال بررسی شد. میزان DTH بر اساس این فرمول محاسبه شد:
[(ضخامت پای راست) _ (ضخامت پای چپ] * 100/ (ضخامت پای چپ)
ارزیابیهای ایمونولوژیک: 14 روز پس از آخرین ایمنسازی، پنج موش در هر گروه با استفاده تزریق داخل صفاقی کتامین (mg/kg100) و زایلازین (mg/kg 10) تحت بیهوشی عمیق قرار گرفتند. ابتدا از موشهای و همچنین موشهای گروه شاهد نمونه خونگرفته شد و سرم آنها جدا شد. تیتر اختصاصی IgG در برابر HKST و نسبت IgG2b/IgG1 سپس با استفاده از روش ELISA طبق روش کاری که در گذشته شرح شده، بررسی شد (3, 16).
تست تکثیر لنفوسیتی: بعد از خونگیری اقدام به خارجسازی طحال از موشها در شرایط آسپتیک گردید. هر نمونه طحال لهشده و از یک شبکه سیمی به قطر 20 میکرومتر عبور داده شد. سوسپانسیون سلولی جداشده با سرعت 2000 دور در دقیقه به مدت 10 دقیقه سانتریفیوژ شد. سلولهای تکهستهای با گرادیان چگالی فایکول-هایپک جدا شدند. گلبولهای قرمز خون توسط بافر لیز کننده ACK (کلرید آمونیوم 15/0 مولار، بیکربنات پتاسیوم 01/0 مولار، و اتیلن دی آمین تترااسات (EDTA)001/0 مولار) حذف شدند. محیط کشت مورداستفاده برای سلولهای طحالی RPMI-1640 و 5 درصد سرم جنین گاوی (FBS) بود. شمارش سلولهای زنده با استفاده از تریپان به لو صورت پذیرفت. هر چاهک با تعداد 104×5/4 سلول باکتری کشتهشده در 100 میکرولیتر تحریک شد. تعداد سلول طحالی به باکتری بر اساس مطالعات قبلی انتخاب شده بود (3،17). پس از 72 ساعت، 250 میکرولیتر MTT mg/ml) 5) به هر چاهک اضافه شد و پس از چهار ساعت انکوباسیون در 37 درجه، مایع رویی خارج و 150 میکرولیتر DMSO به هر چاهک افزوده گردید. با پپیت کردن سریع، کریستالها حل شد. پلیتها در طولموج 570 نانومتر با الایزا ریدر خوانده شد. شاخص تکثیر با توجه به نسبت جذب سلولهای تحریکشده با HKST به جذب سلولهای طحال تحریک نشده گزارش شد. مبنای شمارش تعداد باکتریها بر اساس سنجش میزان کدورت با استفاده از دستگاه اسپکتروفتومتر (روش نیمه مک فارلند) است. عدد 08/0 تا 10/0 بیانگر تعداد 108 باکتری بود (3).
تعیین بار باکتریایی در کبد: دو هفته پس از آخرین ایمنسازی، پنج موش از هر گروه بهصورت داخل صفاقی با 103 باکتری سالمونلا تیفی موریوم زنده (بهعنوان دوز غیر کشنده) تلقیح شدند. موشها 48 ساعت بعد آسان کشی شدند و 20 میلیگرم از بافت کبد هر موش بهطور جداگانه برداشته شد و همگن شد. سپس 10 میکرولیتر از رقتهای مناسب از سلولهای کبد (به نسبت یکبهده در Triton X-100 (05/0 درصد)) بهطور جداگانه روی صفحات سویا تریپتیکاز قرار داده شد و به مدت یک روز در دمای 37 درجه سانتیگراد انکوبه شد. درنهایت، واحدهای تشکیلدهنده کلنی (CFUs) شمارش شدند (3).
ارزیابی درصد بقاء: دو هفته پس از آخرین ایمنسازی، ده موش از هر گروه بهصورت داخل صفاقی با یکمیلیون باکتری زنده سالمونلا تیفی مورویوم (بهعنوان دوز کشنده) ایمن شدند. در این آزمون هدف اصلی سنجش میزان زنده ماندن موشها پس از چالش با دوز کشنده باکتری بود. بنابراین تنها واقعه مرگ جهت ترسیم منحنی کاپلان مایر ثبت شد. بقا به مدت سه هفته موردبررسی قرار گرفت (3).
ارزیابی میزان IL-4 و IFN-ɣ در مایع رویی حاصل از کشت سلولهای طحالی: پس از 48 ساعت کشت سلولهای طحالی در دمای 37 و 5% درصد CO2 مایع رویی برداشت و برای سنجش این سایتوکائینها به روش الایزا با کیتهای شرکت Bendermed انگلستان و طبق دستورالعمل کیت انجام شد (3).
روشهای ارزیابی آماری: میزان بقا توسط تجزیهوتحلیل کاپلان-مایر بررسی شد. سایر یافتهها با استفاده از آنالیز واریانس یکطرفه (ANOVA) و پسازآن آزمون تعقیبی توکی مورد تجزیهوتحلیل قرار گرفت. سطح معنیداری پنج درصد تعیین شد. تمامی نتایج بهصورت میانگین ± انحراف معیار گزارش شد.
یافتهها
تعیین بار باکتریایی در کبد: دو هفته پس از آخرین ایمنسازی، پنج موش از هر گروه بهصورت داخل صفاقی با 103 باکتری سالمونلا تیفی موریوم زنده (بهعنوان دوز غیر کشنده) تلقیح شدند. موشها 48 ساعت بعد آسان کشی شدند و 20 میلیگرم از بافت کبد هر موش بهطور جداگانه برداشته شد و همگن شد. سپس 10 میکرولیتر از رقتهای مناسب از سلولهای کبد (به نسبت یکبهده در Triton X-100 (05/0 درصد)) بهطور جداگانه روی صفحات سویا تریپتیکاز قرار داده شد و به مدت یک روز در دمای 37 درجه سانتیگراد انکوبه شد. درنهایت، واحدهای تشکیلدهنده کلنی (CFUs) شمارش شدند (3).
ارزیابی درصد بقاء: دو هفته پس از آخرین ایمنسازی، ده موش از هر گروه بهصورت داخل صفاقی با یکمیلیون باکتری زنده سالمونلا تیفی مورویوم (بهعنوان دوز کشنده) ایمن شدند. در این آزمون هدف اصلی سنجش میزان زنده ماندن موشها پس از چالش با دوز کشنده باکتری بود. بنابراین تنها واقعه مرگ جهت ترسیم منحنی کاپلان مایر ثبت شد. بقا به مدت سه هفته موردبررسی قرار گرفت (3).
ارزیابی میزان IL-4 و IFN-ɣ در مایع رویی حاصل از کشت سلولهای طحالی: پس از 48 ساعت کشت سلولهای طحالی در دمای 37 و 5% درصد CO2 مایع رویی برداشت و برای سنجش این سایتوکائینها به روش الایزا با کیتهای شرکت Bendermed انگلستان و طبق دستورالعمل کیت انجام شد (3).
روشهای ارزیابی آماری: میزان بقا توسط تجزیهوتحلیل کاپلان-مایر بررسی شد. سایر یافتهها با استفاده از آنالیز واریانس یکطرفه (ANOVA) و پسازآن آزمون تعقیبی توکی مورد تجزیهوتحلیل قرار گرفت. سطح معنیداری پنج درصد تعیین شد. تمامی نتایج بهصورت میانگین ± انحراف معیار گزارش شد.

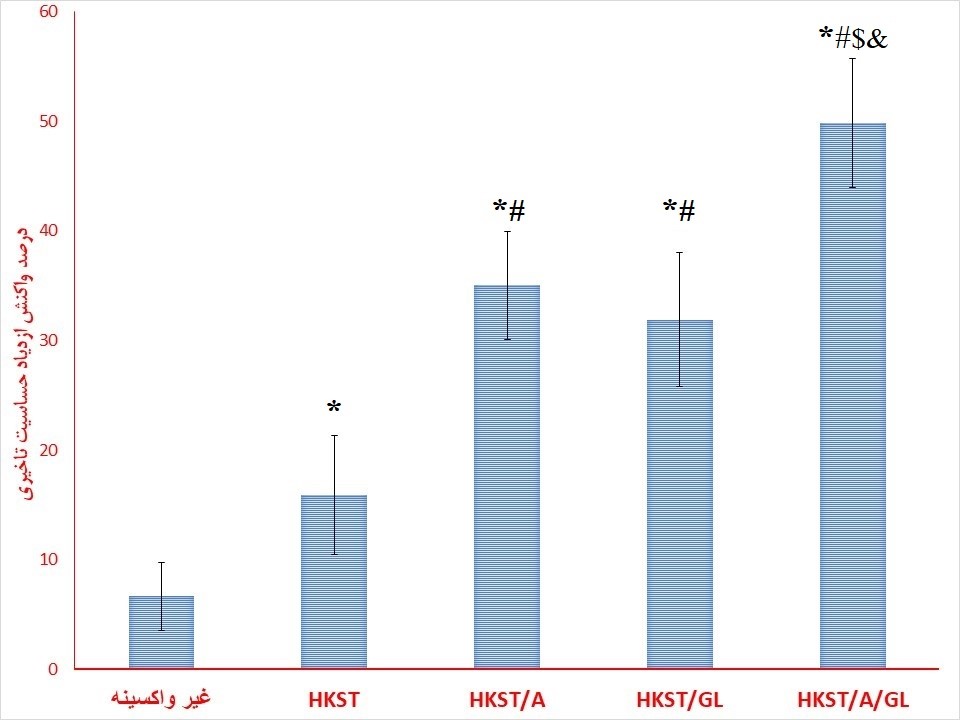
HKST/GL/A در مقایسه با سایر گروهها مشاهده شد. بهطور متوسط، افزایش 14/3 برابری در شدت این واکنش در موشهای واکسینه شده با HKST/GL/A در مقایسه با گروهی که HKST دریافت کردند، مشاهده شد (نمودار 1).
این واکنش در گروههای HKST/A و HKST/GL در مقایسه با واکنش DTH در گروههای HKST و بدون بیشتر بود (نمودار 1). میانگین افزایش واکنش DTH در موشهای واکسینه شده با HKST/A یا HKST/GL به ترتیب 2/2 برابر و 01/2 برابر بیشتر از گروه HKST بود. بر اساس یافتهها، تفاوت معنیداری بین گروههای HKST/A و HKST/GL وجود نداشت (نمودار 1).
نمودار (1): اثرات استفاده از ادواجنتها بر روی بر واکنش DTH.
* نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه غیر واکسینه است.# نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST است.$ نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST/A است.$ نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST/GL است. (باکتری کشتهشده، HKST/A: باکتری کشتهشده + آلوم، HKST/GL: باکتری کشتهشده + لیپوزوم و HKST/GL/A: باکتری کشتهشده + آلوم + لیپوزوم).
* نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه غیر واکسینه است.# نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST است.$ نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST/A است.$ نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST/GL است. (باکتری کشتهشده، HKST/A: باکتری کشتهشده + آلوم، HKST/GL: باکتری کشتهشده + لیپوزوم و HKST/GL/A: باکتری کشتهشده + آلوم + لیپوزوم).
همانطور که در نمودار 2-الف نشان داده شده است، بالاترین تولید IFN-γ در سوپ رویی سلولهای طحال موشهایی که HKST/GL/A دریافت کرده بودند، مشاهده شد. بهاینترتیب، در گروه دریافتکننده ادجوانت ترکیبی، افزایش 2 برابری در تولید IFN-γ در مقایسه با گروهی که تنها با HKST واکسینه شده بودند، مشاهده شد (نمودار 2). میزان IFN-γ در سوپ سلولهای طحال موشهای واکسینه شده با HKST/GL در مقایسه با سلولهای طحال موشهایی که HKST/A، HSKT یا موشهای کنترل دریافت کردند، بالاتر بود. بیان IFN-γ در سلولهای طحال موشهایی که تنها با HSKT واکسینه شده بودند بهطور معنیداری بیشتر از موشهای گروه HKST/A یا گروه بدون واکسن بود (نمودار 2-الف).
تولید IL-4 در سوپ رویی سلولهای طحالی موشهای تحت تیمار شده با HKST/A در مقایسه با گروههای دیگر بهطور معنیداری بیشتر بود (نمودار 2-ب). بیان IL-4 در سلولهای طحال موشهایی که HKST را بهتنهایی دریافت کردند در مقایسه با سلولهای طحال موشهایی که با HKST/A/G یا با HKST واکسینه شده بودند، بیشتر بود (نمودار 2-ب). میزان تولید IL-4 در سوپ رویی سلولهای طحالی در گروه دریافتکننده ادجوانت ترکیبی با گروه بدون واکسن تفاوت معنیداری نداشت (نمودار 2- ب).
تولید IL-4 در سوپ رویی سلولهای طحالی موشهای تحت تیمار شده با HKST/A در مقایسه با گروههای دیگر بهطور معنیداری بیشتر بود (نمودار 2-ب). بیان IL-4 در سلولهای طحال موشهایی که HKST را بهتنهایی دریافت کردند در مقایسه با سلولهای طحال موشهایی که با HKST/A/G یا با HKST واکسینه شده بودند، بیشتر بود (نمودار 2-ب). میزان تولید IL-4 در سوپ رویی سلولهای طحالی در گروه دریافتکننده ادجوانت ترکیبی با گروه بدون واکسن تفاوت معنیداری نداشت (نمودار 2-
.jpg)
نمودار (2): اثرات استفاده از ادواجنتها بر روی بر میزان تولید سایتوکاینهای IFN-γ الف) و ب) IL-4 در سوپ رویی کشت سلولهای طحالی
* نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه غیر واکسینه است.# نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST است.$ نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST/A است.$ نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST/GL است. (باکتری کشتهشده، HKST/A: باکتری کشتهشده + آلوم، HKST/GL: باکتری کشتهشده + لیپوزوم و HKST/GL/A: باکتری کشتهشده + آلوم + لیپوزوم).
تفاوت معنیداری در شدت تکثیر لنفوسیتهای طحالی بین گروههای بدون واکسن و دریافتکننده HKST وجود داشت (نمودار 3). شدت تکثیر لنفوسیتهای طحالی در گروه HKST/GL/A و به دنبال آن گروههای HKST/ GL و HKST/A بهطور معنیداری بیشتر از گروه دریافتکننده HKST بود. هرچند که بین سه گروه اخیر تفاوت معنیداری وجود نداشت (نمودار 3).
.jpg)
نمودار (3): تأثیر ادواجنتها بر روی شدت تکثیر لنفوسیتهای طحالی
* نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه غیر واکسینه است.# نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST است.$ نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST/A است.$ نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST/GL است. (باکتری کشتهشده، HKST/A: باکتری کشتهشده + آلوم، HKST/GL: باکتری کشتهشده + لیپوزوم و HKST/GL/A: باکتری کشتهشده + آلوم + لیپوزوم).
ازنظر تیترهای IgG اختصاصی علیه HKST، گروهی که HKST/GL/A و یا HKST/A را دریافت کردند، بالاترین تیترها را در مقایسه با گروههای دیگر داشتند (نمودار 4). تیتر آنتیبادی در گروه HKST/GL در مقایسه با موشهایی که HKST یا گروههای کنترل دریافت کردند، بالاتر بود. بااینحال، بهطور معنیداری از گروههای دریافتکننده شکل کشتهشده و آلوم و گروه دریافتکننده شکل کشتهشده و ادجوانت ترکیبی کمتر بود (نمودار 4). همانطور که در نمودار 4 گزارش شده است، نسبت IgG2b/IgG1 در موشهایی که با HKST/GL/A واکسینه شده بودند در مقایسه با حیواناتی که با پروتکلهای دیگر واکسینه شده بودند بهطور معنیداری بالاتر بود. موشهای گروه HKST/GL نسبت IgG2b/IgG1 بهطور معنیداری در مقایسه موشهای دریافتکننده HKST/A، HKST و کنترل بیشتر بود (نمودار 4). بهطور معنیداری نسبت IgG2b/IgG1 در موشهایی که با HKST/A واکسینه شدند پایینتر از این نسبت در حیواناتی که تنها HKST دریافت کردند، بود (نمودار 4).
.jpg)
نمودار (4): اثرات واکسیناسیون بر پاسخ آنتیبادی
سمت چپ) میانگین سطح سرمی IgG در برابر HKST، سمت راست) ارزیابی نسبت IgG2b/IgG1.. * نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه غیر واکسینه است.# نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST است.$ نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST/A است.$ نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST/GL است. (باکتری کشتهشده، HKST/A: باکتری کشتهشده + آلوم، HKST/GL: باکتری کشتهشده + لیپوزوم و HKST/GL/A: باکتری کشتهشده + آلوم + لیپوزوم).
کشت کبدهای هموژن شده از موشهایی که HKST/GL/A دریافت کرده بودند نشان داد که میانگین تعداد کلنیهای باکتریایی بهطور قابلتوجهی کمتر از میانگین تعداد کلنیهای باکتریایی ثبتشده از گروههای دیگر است (نمودار 5). بهطور متوسط، یک کاهش 82 درصدی در میانگین تعداد کلنیهای باکتریایی در موشهای واکسینه شده با HKST/GL/A در مقایسه با گروهی که HKST دریافت کردند، مشاهده شد. همانطور که انتظار میرفت، بیشترین تعداد کلنیهای باکتریایی در گروهی که واکسینه نشده بودند مشاهده شد. علاوه بر این، بار باکتریایی در گروه HKST/GL بهطور معنیداری کمتر از گروه آلوم HKST/A بود. البته بار باکتریایی در گروههای HKST/GL و HKST/A بهطور قابلتوجهی کمتر از گروههای HKST و کنترل بود (نمودار 5).
.PNG)
نمودار (5): میزان بار باکتریایی در طحال موشهای واکسینه شده
* نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه غیر واکسینه است.# نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST است.$ نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST/A است.$ نشاندهنده اختلاف تفاوت معنیدار در سطح 05/0P< نسبت به گروه HKST/GL است. (باکتری کشتهشده، HKST/A: باکتری کشتهشده + آلوم، HKST/GL: باکتری کشتهشده + لیپوزوم و HKST/GL/A: باکتری کشتهشده + آلوم + لیپوزوم).
همانطور که انتظار میرفت، با توجه به نتایج ذکرشده در بالا، بیشترین درصد بقای موشها پس از دریافت دوز کشنده S. typhimurium زنده متعلق به گروه HKST/GL/A بود (نمودار 6). در این گروه پس از سه هفته 67 درصد موشها زنده بودند. در گروه دریافتکننده واکسنهای HKST/GL هیچکدام از موشها طی
هفته دوم پس از تلقیح با باکتریهای زنده در دوز کشنده زنده نبودند (نمودار 6). تنها یک موش در گروه دریافتکننده آلوم و شکل کشتهشده باکتری توانست که یک هفته زنده بماند. تمام موشهای گروه HKST پس از چالش با باکتری زنده تا روز 5 تلف شدند. این عدد برای موشهای گروه غیر واکسینه تنها دو روز بود (نمودار 6).
.jpg)
نمودار (6): میزان بقای موشها پس از چالش با S. typhimurium زنده
حروف مختلف نشاندهنده تفاوت معنیدار در سطح 05/0P< است (باکتری کشتهشده، HKST/A: باکتری کشتهشده + آلوم، HKST/GL: باکتری کشتهشده + لیپوزوم و HKST/GL/A: باکتری کشتهشده + آلوم + لیپوزوم).
بحث و نتیجهگیری
دلیل اصلی استفاده از ادجوانتها در واکسنهای کشتهشده فراهم آوردن آزادسازی تدریجی آنتیژنها و بیان مولکولهای تحریککننده مانند CD80 و CD86 توسط سلولهای ارائهدهنده آنتیژن[2](APC ها (شامل سلولهای دندریتیک، لنفوسیتهای B و ماکروفاژها و نیز هدایت تولید سایتوکائینهای پلاریزه کننده پاسخهای ایمنی توسط APC ها است (2, 17). منطق درمان ترکیبی برای کنترل بیماریهای پیچیده مبتنی بر استفاده از دو یا چند دارو با مکانیسمهای درمانی متفاوت است (18, 19). بدیهی است که ترکیب ادجوانتها برای دستیابی به همافزایی و حصول نتیجه مناسبتر هم به همان منطق نیاز دارد. آلوم (سولفات آلومینیوم پتاسیم) از سال 1920 بهعنوان پرمصرفترین ادجوانت شناختهشده است (20). علاوه بر خاصیت ذخیرهکنندگی و آزادسازی بطئی آنتیژن، آلوم از طریق القای اینفلامازم[3] توسط ماکروفاژهای بافتی موجب القای سایتوکائین و کموکائینهایی خواهد شد که درنهایت منجر به تجمع، بلوغ و مهاجرت APC ها پس از برداشت آنتیژن میگردد (17, 20, 21). درمجموع، آلوم یک پاسخ Th2 را القا میکند (3, 20)
درگذشته نشان داده شده است که سلولهای دندریتیک تیمار شده با گلایسریزیک اسید قادر به تأثیرگذاری بر تمایز سلولهای T به سمت زیرمجموعه Th1 و درنتیجه ایجاد پاسخهای ایمنی سلولی بودند. علاوه بر این، گلایسریزیک اسید قادر به مسدود کردن سنتز پروستاگلاندین-E2 از طریق مسدود کردن سیکلواکسیژناز- 2 است که منجر به افزایش همزمان تولید اکسید نیتریک از طریق افزایش بیان ژن iNOS2 در ماکروفاژهای آلوده به لیشمانیا میشود. به عبارتی گلایسیریزیک اسید منجر به تقویت قدرت عملکردی ماکروفاژها میگردد. از سوی دیگر، Bhattacharjee و همکاران نشان داد که گلایسریزیک اسید قادر به مسدود کردن بیان Th2، IL-10، و TGF-β از سلولهای طحال موشهای آلوده به لیشمانیا است. همچنین گزارش داده شده است که گلایسریزیک اسید در موش موجب بلوغ DC ها را تقویت کند و این فعالیت ادجوانت مانند ممکن است ارزش درمانی بالقوه به دلیل افزایش بیان CD86، CD40، CD80، CD83 و کمپلکس اصلی سازگاری بافتی نوع II (MHC II) داشته باشد. همانطور که در مقدمه تشریح شده به دلیل حلالیت کم و اثرات جانبی گلایسریزیک اسید، وارد کردن این ترکیب در یک فرم لیپوزومی منطقی است. لیپوزومها منجر به رسانش مؤثر گلایسریزیک اسید به سلولهای عرضهکننده آنتیژن میگردند (10).
نتایج پژوهش حاضر بهوضوح نشان داد که لیپوزم گلایسریزیک اسید موجب تقویت پاسخها به سمت پاسخهای ایمنی سلولی در مقایسه با آلوم میگردد. مهمتر از آن، ترکیب آلوم و لیپوزم گلایسریزیک اسید پاسخهای قویتر Th1 را القا کرد و بهطور همزمان ایمنی سلولی و ایمنی هومورال را تقویت کرد. نتایج پژوهشهای قبلی نشان داده است که میتوان پاسخهای ایمنی واکسن S. typhimurium را از طریق مخلوط متوکلوپرامید-آلوم، آلوم-نالوکسون یا مخلوط پروپرانولول- آلوم بهعنوان کمکهای واکسن تقویت کرد (16). نتایج تحقیق حاضر در رابطه با مزایای لیپوزوم اسید گلایسریزیک بهعنوان یک ادجوانت همراه با شواهد قبلی در مورد فعالیت کمکی پروپرانولول و نالوکسان حاکی از آن است که ریزمحیط در زمان تشکیل پاسخهای ایمنی نقش اساسی در سرنوشت پاسخ ایمنی اکتسابی علیه آنتیژنها دارد. برخلاف یک ترکیب محرک ایمنی، یک ادجوانت باید در مخلوط کامل با یک آنتیژن تزریق شود تا اثر مفید خود را در افزایش پاسخ ایمنی خاص در برابر یک آنتیژن تنها زمانی که پاسخهای ایمنی خاص تشکیل میشود، اعمال کند (20). به همین دلیل، مشابه آزمایشهای ذکرشده در بالا، لیپوزوم اسید گلایسریزیک در مخلوطی با شکل کشتهشده سالمونلا تیفی موریوم تجویز شد.
نتایج پیشین نشان داد که لیپوزومهای گلایسریزیک اسید بهطور قابلتوجهی تیتر آنتیبادی از کلاسهای IgG و IgM را در مرغهای واکسینه شده با واکسن نیوکاسل افزایش داده است (10). آلوم نیز یکی از ادجوانتهای معروف است که ایمنیزایی و تولید آنتیبادی را به دنبال استفاده از شکل کشتهشده پاتوژنها افزایش میدهد (7, 8, 17). براساس یافتههای حاضر، هر دو ادجوانتهای آلوم و لیپوزومهای گلایسریزیک اسید در افزایش آنتیبادیهای خنثی کننده علیه سالمونلا تیفی موریوم موفق بودند. علاوه بر این، ترکیب این دو عامل منجر به اثر همافزایی در تولید آنتیبادیهای خنثی کننده علیه سالمونلا تیفی موریوم شد.
بسته به نوع سایتوکائینهای تولید شده توسط APC ها، لنفوسیتهای T در جهات مختلف پلاریزه میشوند و عملکردهای متفاوتی را به عهده میگیرند. IFN-γ بهعنوان سایتوکائین اصلی پاسخهای Th1 در نظر گرفته میشود (22). از سوی دیگر، IL-4، بهعنوان سایتوکائین اصلی Th2 محسوب میشود (22, 23). مطمئناً ریزمحیط ایجاد شده توسط ادجوانت ها در پلاریزه کردن پاسخ ایمنی مؤثر است. نقش آلوم در پلاریزه کردن پاسخها به سمت Th2 کاملاً شناخته شده است (20). همان طور که ذکر شد بر عکس آلوم، سلولهای دندریتیک تیمار شده با گلایسریزیک اسید قادر به تأثیرگذاری بر تمایز سلولهای T به سمت زیرمجموعه Th1 بودهاند (24). بر این اساس، دادههای حاضر نشان داد که تحریک ex vivo سلولهای طحال موشهایی که HKST و آلوم دریافت کردند، منجر به بیان بالاتر mRNA IL-4 در مقایسه با سایر گروهها شد. برعکس، تحریک ex vivo سلولهای طحال موشهایی که HKST و ترکیبی از آلوم و لیپوزوم گلایسریزیک اسید دریافت کردند، منجر به بیان بالاتر mRNA ژن IFN-γ در مقایسه با گروههای دیگر شد. مرتبه دوم بیان mRNA IFN-γ مربوط به اسپلنوسیت سلولهای طحالی موشهایی است که HKST و لیپوزومهای گلایسریزیک اسید دریافت کردهاند.
لنفوسیتهای T مسئول تولید آنتیبادیهای با تیتر بالا از کلاس IgG هستند (25, 26). هر دو پاسخهای Th1 و Th2 در ایجاد پاسخ مؤثر ضد آنتیبادی مؤثر هستند (26, 27). بااینحال، ایزوتیپهای آنتیبادی تولید شده در طول پاسخهای Th1، پتانسیل اپسونیزاسیون و قدرت فعالسازی مکمل قویتری نسبت به آنتیبادیهای تولید شده در طی پاسخهای Th2 دارند (27). با توجه به موارد فوق، ایجاد پاسخ Th1 برای کنترل عفونتی مانند عفونت سالمونلا اهمیت بیشتری دارد. در موشها، IFN-γ تولید شده توسط سلولهای Th1 از سوئیچ ایزوتیپ IgG2a پشتیبانی میکند، درحالیکه IL-4 تولید شده توسط سلولهای Th2 از سوئیچ ایزوتیپ IgG1 پشتیبانی میکند (28). تجزیهوتحلیل نتایج تحقیقات ما نشان داد که بیشترین نسبت آنتیبادی IgG2b به IgG1 در گروهی که HKST و ادجوانت ترکیبی دریافت کردند مشاهده شد. در این راستا، حیواناتی که HKST را با آلوم تجویز کردند، نسبت IgG2b/IgG1 کمتری در مقایسه با نسبتهای مشاهدهشده در موشهایی که HKST و لیپوزم گلایسریزیک اسید دریافت کردند، داشتند. این نتایج کاملاً مطابق با نتایج تجزیهوتحلیل انجام شده در مورد بیان mRNA ژنهای IFN-γ و IL-4 بود.
سنجش واکنش حساسیت تأخیری (DTH) یکی از رایجترین روشها برای ارزیابی پاسخهای ایمنی سلولی در برابر یک آنتیژن خاص است. بازیگران اصلی در واکنش DTH، Th1 و ماکروفاژها هستند. نتایج این سنجش با نتایج مربوط به پلاریزاسیون و بقای T- helper مطابقت داشت و بهترین نتایج در موشهای دریافتکننده HKST و ادجوانتهای ترکیبی مشاهده شد. ارزیابی تکثیر لنفوسیت اختصاصی S. typhimurium روش دیگری بود که برای ارزیابی ایمنی سلولی در مطالعه حاضر مورد استفاده قرار گرفت. در اینجا، نتایج همچنین یک همافزایی بین آلوم و لیپوزوم اسید گلایسیریزیک را در افزایش پاسخهای ایمنی ناشی از واکسن HKST نشان میدهد.
بیشترین درصد بقا پس از به چالش کشیدن سلولها با باکتریهای زنده متعلق به گروه دریافتکننده واکسن و ادجوانت ترکیبی بود و پسازآن موشهای دریافتکننده HKST و لیپوزوم گلایسریزیک اسید، موشهایی که HKST و آلوم دریافت کردند و درنهایت موشهایی که فقط HSKT دریافت کردند، قرار گرفتند. همانطور که انتظار میرفت، گروهی که کمترین درصد بقا را داشتند، گروهی بودند که هیچ واکسنی دریافت نکردند.
بهطور کلی، ترکیب آلوم و لیپوزم گلایسریزیک اسید بهعنوان یک ادجوانت در ارتباط با واکسن HKST میتواند ایمنی سلولی و هومورال را ایجاد کند و پاسخ ایمنی را به سمت Th1 تغییر دهد. بنابراین، این ترکیب ممکن است ابزارهای جدید و ایمن را برای تقویت پاسخهای ایمنی سلولی ناشی از واکسن در برابر میکروبها و سرطانهای مختلف آماده کند. علاوه بر این، نتایج حاضر نشان داد که تجویز لیپوزم گلایسریزیک اسید، حتی بدون آلوم، همراه با واکسن HKST باعث افزایش ایمنی سلولی میشود. بر اساس اطلاعات نویسندگان پژوهش حاضر، این مطالعه اولین تحقیقی است که اثرات ترکیب آلوم و لیپوزم گلایسریزیک اسید را بهعنوان یک عنوان ادجوانت در واکسن حاصل از شکل کشتهشده یک باکتری ارزیابی نموده است. بنابراین، مطالعات بعدی برای تأیید این نتایج و همین تأیید قابلیت کاربردی ترکیب آلوم و لیپوزم گلایسریزیک اسید در صورت ترکیب با واکسنهایی علیه سایر میکروارگانیسمهایی که نیاز به پاسخهای ایمنی هومورال و سلولی دارند، مورد نیاز است. همچنین برای نتیجه بخشی بهتر، میتوان از روشهای به دام اندازی آنتیژن خالص در داخل لیپوزوم نیز در پژوهشهای آینده استفاده نمود.
درگذشته نشان داده شده است که سلولهای دندریتیک تیمار شده با گلایسریزیک اسید قادر به تأثیرگذاری بر تمایز سلولهای T به سمت زیرمجموعه Th1 و درنتیجه ایجاد پاسخهای ایمنی سلولی بودند. علاوه بر این، گلایسریزیک اسید قادر به مسدود کردن سنتز پروستاگلاندین-E2 از طریق مسدود کردن سیکلواکسیژناز- 2 است که منجر به افزایش همزمان تولید اکسید نیتریک از طریق افزایش بیان ژن iNOS2 در ماکروفاژهای آلوده به لیشمانیا میشود. به عبارتی گلایسیریزیک اسید منجر به تقویت قدرت عملکردی ماکروفاژها میگردد. از سوی دیگر، Bhattacharjee و همکاران نشان داد که گلایسریزیک اسید قادر به مسدود کردن بیان Th2، IL-10، و TGF-β از سلولهای طحال موشهای آلوده به لیشمانیا است. همچنین گزارش داده شده است که گلایسریزیک اسید در موش موجب بلوغ DC ها را تقویت کند و این فعالیت ادجوانت مانند ممکن است ارزش درمانی بالقوه به دلیل افزایش بیان CD86، CD40، CD80، CD83 و کمپلکس اصلی سازگاری بافتی نوع II (MHC II) داشته باشد. همانطور که در مقدمه تشریح شده به دلیل حلالیت کم و اثرات جانبی گلایسریزیک اسید، وارد کردن این ترکیب در یک فرم لیپوزومی منطقی است. لیپوزومها منجر به رسانش مؤثر گلایسریزیک اسید به سلولهای عرضهکننده آنتیژن میگردند (10).
نتایج پژوهش حاضر بهوضوح نشان داد که لیپوزم گلایسریزیک اسید موجب تقویت پاسخها به سمت پاسخهای ایمنی سلولی در مقایسه با آلوم میگردد. مهمتر از آن، ترکیب آلوم و لیپوزم گلایسریزیک اسید پاسخهای قویتر Th1 را القا کرد و بهطور همزمان ایمنی سلولی و ایمنی هومورال را تقویت کرد. نتایج پژوهشهای قبلی نشان داده است که میتوان پاسخهای ایمنی واکسن S. typhimurium را از طریق مخلوط متوکلوپرامید-آلوم، آلوم-نالوکسون یا مخلوط پروپرانولول- آلوم بهعنوان کمکهای واکسن تقویت کرد (16). نتایج تحقیق حاضر در رابطه با مزایای لیپوزوم اسید گلایسریزیک بهعنوان یک ادجوانت همراه با شواهد قبلی در مورد فعالیت کمکی پروپرانولول و نالوکسان حاکی از آن است که ریزمحیط در زمان تشکیل پاسخهای ایمنی نقش اساسی در سرنوشت پاسخ ایمنی اکتسابی علیه آنتیژنها دارد. برخلاف یک ترکیب محرک ایمنی، یک ادجوانت باید در مخلوط کامل با یک آنتیژن تزریق شود تا اثر مفید خود را در افزایش پاسخ ایمنی خاص در برابر یک آنتیژن تنها زمانی که پاسخهای ایمنی خاص تشکیل میشود، اعمال کند (20). به همین دلیل، مشابه آزمایشهای ذکرشده در بالا، لیپوزوم اسید گلایسریزیک در مخلوطی با شکل کشتهشده سالمونلا تیفی موریوم تجویز شد.
نتایج پیشین نشان داد که لیپوزومهای گلایسریزیک اسید بهطور قابلتوجهی تیتر آنتیبادی از کلاسهای IgG و IgM را در مرغهای واکسینه شده با واکسن نیوکاسل افزایش داده است (10). آلوم نیز یکی از ادجوانتهای معروف است که ایمنیزایی و تولید آنتیبادی را به دنبال استفاده از شکل کشتهشده پاتوژنها افزایش میدهد (7, 8, 17). براساس یافتههای حاضر، هر دو ادجوانتهای آلوم و لیپوزومهای گلایسریزیک اسید در افزایش آنتیبادیهای خنثی کننده علیه سالمونلا تیفی موریوم موفق بودند. علاوه بر این، ترکیب این دو عامل منجر به اثر همافزایی در تولید آنتیبادیهای خنثی کننده علیه سالمونلا تیفی موریوم شد.
بسته به نوع سایتوکائینهای تولید شده توسط APC ها، لنفوسیتهای T در جهات مختلف پلاریزه میشوند و عملکردهای متفاوتی را به عهده میگیرند. IFN-γ بهعنوان سایتوکائین اصلی پاسخهای Th1 در نظر گرفته میشود (22). از سوی دیگر، IL-4، بهعنوان سایتوکائین اصلی Th2 محسوب میشود (22, 23). مطمئناً ریزمحیط ایجاد شده توسط ادجوانت ها در پلاریزه کردن پاسخ ایمنی مؤثر است. نقش آلوم در پلاریزه کردن پاسخها به سمت Th2 کاملاً شناخته شده است (20). همان طور که ذکر شد بر عکس آلوم، سلولهای دندریتیک تیمار شده با گلایسریزیک اسید قادر به تأثیرگذاری بر تمایز سلولهای T به سمت زیرمجموعه Th1 بودهاند (24). بر این اساس، دادههای حاضر نشان داد که تحریک ex vivo سلولهای طحال موشهایی که HKST و آلوم دریافت کردند، منجر به بیان بالاتر mRNA IL-4 در مقایسه با سایر گروهها شد. برعکس، تحریک ex vivo سلولهای طحال موشهایی که HKST و ترکیبی از آلوم و لیپوزوم گلایسریزیک اسید دریافت کردند، منجر به بیان بالاتر mRNA ژن IFN-γ در مقایسه با گروههای دیگر شد. مرتبه دوم بیان mRNA IFN-γ مربوط به اسپلنوسیت سلولهای طحالی موشهایی است که HKST و لیپوزومهای گلایسریزیک اسید دریافت کردهاند.
لنفوسیتهای T مسئول تولید آنتیبادیهای با تیتر بالا از کلاس IgG هستند (25, 26). هر دو پاسخهای Th1 و Th2 در ایجاد پاسخ مؤثر ضد آنتیبادی مؤثر هستند (26, 27). بااینحال، ایزوتیپهای آنتیبادی تولید شده در طول پاسخهای Th1، پتانسیل اپسونیزاسیون و قدرت فعالسازی مکمل قویتری نسبت به آنتیبادیهای تولید شده در طی پاسخهای Th2 دارند (27). با توجه به موارد فوق، ایجاد پاسخ Th1 برای کنترل عفونتی مانند عفونت سالمونلا اهمیت بیشتری دارد. در موشها، IFN-γ تولید شده توسط سلولهای Th1 از سوئیچ ایزوتیپ IgG2a پشتیبانی میکند، درحالیکه IL-4 تولید شده توسط سلولهای Th2 از سوئیچ ایزوتیپ IgG1 پشتیبانی میکند (28). تجزیهوتحلیل نتایج تحقیقات ما نشان داد که بیشترین نسبت آنتیبادی IgG2b به IgG1 در گروهی که HKST و ادجوانت ترکیبی دریافت کردند مشاهده شد. در این راستا، حیواناتی که HKST را با آلوم تجویز کردند، نسبت IgG2b/IgG1 کمتری در مقایسه با نسبتهای مشاهدهشده در موشهایی که HKST و لیپوزم گلایسریزیک اسید دریافت کردند، داشتند. این نتایج کاملاً مطابق با نتایج تجزیهوتحلیل انجام شده در مورد بیان mRNA ژنهای IFN-γ و IL-4 بود.
سنجش واکنش حساسیت تأخیری (DTH) یکی از رایجترین روشها برای ارزیابی پاسخهای ایمنی سلولی در برابر یک آنتیژن خاص است. بازیگران اصلی در واکنش DTH، Th1 و ماکروفاژها هستند. نتایج این سنجش با نتایج مربوط به پلاریزاسیون و بقای T- helper مطابقت داشت و بهترین نتایج در موشهای دریافتکننده HKST و ادجوانتهای ترکیبی مشاهده شد. ارزیابی تکثیر لنفوسیت اختصاصی S. typhimurium روش دیگری بود که برای ارزیابی ایمنی سلولی در مطالعه حاضر مورد استفاده قرار گرفت. در اینجا، نتایج همچنین یک همافزایی بین آلوم و لیپوزوم اسید گلایسیریزیک را در افزایش پاسخهای ایمنی ناشی از واکسن HKST نشان میدهد.
بیشترین درصد بقا پس از به چالش کشیدن سلولها با باکتریهای زنده متعلق به گروه دریافتکننده واکسن و ادجوانت ترکیبی بود و پسازآن موشهای دریافتکننده HKST و لیپوزوم گلایسریزیک اسید، موشهایی که HKST و آلوم دریافت کردند و درنهایت موشهایی که فقط HSKT دریافت کردند، قرار گرفتند. همانطور که انتظار میرفت، گروهی که کمترین درصد بقا را داشتند، گروهی بودند که هیچ واکسنی دریافت نکردند.
بهطور کلی، ترکیب آلوم و لیپوزم گلایسریزیک اسید بهعنوان یک ادجوانت در ارتباط با واکسن HKST میتواند ایمنی سلولی و هومورال را ایجاد کند و پاسخ ایمنی را به سمت Th1 تغییر دهد. بنابراین، این ترکیب ممکن است ابزارهای جدید و ایمن را برای تقویت پاسخهای ایمنی سلولی ناشی از واکسن در برابر میکروبها و سرطانهای مختلف آماده کند. علاوه بر این، نتایج حاضر نشان داد که تجویز لیپوزم گلایسریزیک اسید، حتی بدون آلوم، همراه با واکسن HKST باعث افزایش ایمنی سلولی میشود. بر اساس اطلاعات نویسندگان پژوهش حاضر، این مطالعه اولین تحقیقی است که اثرات ترکیب آلوم و لیپوزم گلایسریزیک اسید را بهعنوان یک عنوان ادجوانت در واکسن حاصل از شکل کشتهشده یک باکتری ارزیابی نموده است. بنابراین، مطالعات بعدی برای تأیید این نتایج و همین تأیید قابلیت کاربردی ترکیب آلوم و لیپوزم گلایسریزیک اسید در صورت ترکیب با واکسنهایی علیه سایر میکروارگانیسمهایی که نیاز به پاسخهای ایمنی هومورال و سلولی دارند، مورد نیاز است. همچنین برای نتیجه بخشی بهتر، میتوان از روشهای به دام اندازی آنتیژن خالص در داخل لیپوزوم نیز در پژوهشهای آینده استفاده نمود.
تشکر و قدردانی
نویسنگان از دانشگاه ارومیه جهت حمایت مالی و تجهیزات، همچنین از جناب آقای اصغر علیاری کارشناس محترم آزمایشگاه ایمنی شناسی دانشکده دامپزشکی دانشگاه ارومیه کمال تشکر و قدردانی را دارند.
نوع مطالعه: پژوهشي(توصیفی- تحلیلی) |
موضوع مقاله:
ایمونولوژی
فهرست منابع
1. Andre FE, Booy R, Bock HL, Clemens J, Datta SK, John TJ, et al. Vaccination greatly reduces disease, disability, death and inequity worldwide. Bull World Health Organ 2008;86(2):140-6. [DOI:10.2471/BLT.07.040089] [PMID] [PMCID]
2. Reed SG, Bertholet S, Coler RN, Friede M. New horizons in adjuvants for vaccine development. Trends Immunol 2009;30(1):23-32. [DOI:10.1016/j.it.2008.09.006] [PMID]
3. Mazloomi E, Jazani NH, Shahabi S. A novel adjuvant, mixture of alum and the beta-adrenergic receptor antagonist propranolol, elicits both humoral and cellular immune responses for heat-killed Salmonella typhimurium vaccine. Vaccine 2012;30(16):2640-6. [DOI:10.1016/j.vaccine.2012.02.017] [PMID]
4. Takaya A, Yamamoto T, Tokoyoda K. Humoral immunity vs. Salmonella. Front Immunol 2020; 10: 3155. [DOI:10.3389/fimmu.2019.03155] [PMID] [PMCID]
5. Eneslätt K, Golovliov I, Rydén P, Sjöstedt A. Vaccine-mediated mechanisms controlling replication of Francisella tularensis in human peripheral blood mononuclear cells using a co-culture system. Front Cell Infect Microbiol 2018;8:27. [DOI:10.3389/fcimb.2018.00027] [PMID] [PMCID]
6. Chan J, Mehta S, Bharrhan S, Chen Y, Achkar JM, Casadevall A, et al., editors. The role of B cells and humoral immunity in Mycobacterium tuberculosis infection. Cell Infect 2014: Elsevier. [DOI:10.1016/j.smim.2014.10.005] [PMID] [PMCID]
7. Bastola R, Noh G, Keum T, Bashyal S, Seo J-E, Choi J, et al. Vaccine adjuvants: smart components to boost the immune system. Arch Pharm Res 2017;40(11):1238-48. [DOI:10.1007/s12272-017-0969-z] [PMID]
8. Burakova Y, Madera R, McVey S, Schlup JR, Shi J. Adjuvants for animal vaccines. Viral Immunol 2018;31(1):11-22. [DOI:10.1089/vim.2017.0049] [PMID]
9. Ye Y, Chen F, Sun H, Li X, Xu S. Stemucronatoside K, a novel C21 steroidal glycoside from Stephanotis mucronata, inhibited the cellular and humoral immune response in mice. Int. Immunopharmacol 2008;8(9):1231-8. [DOI:10.1016/j.intimp.2008.04.014] [PMID]
10. Zhao X, Fan Y, Wang D, Hu Y, Guo L, Ruan S, et al. Immunological adjuvant efficacy of glycyrrhetinic acid liposome against Newcastle disease vaccine. Vaccine 2011;29(52):9611-7. [DOI:10.1016/j.vaccine.2011.10.053] [PMID]
11. Abe N, Ebina T, Ishida N. Interferon induction by glycyrrhizin and glycyrrhetinic acid in mice. Microbiol Immunol 1982;26(6):535-9. [DOI:10.1111/j.1348-0421.1982.tb00207.x] [PMID]
12. Gløgård C, Stensrud G, Hovland R, Fossheim SL, Klaveness J. Liposomes as carriers of amphiphilic gadolinium chelates: the effect of membrane composition on incorporation efficacy and in vitro relaxivity. Int J Pharm 2002;233(1-2):131-40. [DOI:10.1016/S0378-5173(01)00935-8] [PMID]
13. Gregoriadis G, Gursel I, Gursel M, McCormack B. Liposomes as immunological adjuvants and vaccine carriers. J Control Release 1996;41(1-2):49-56. [DOI:10.1016/0168-3659(96)01355-7]
14. Perrie Y, Crofts F, Devitt A, Griffiths HR, Kastner E, Nadella V. Designing liposomal adjuvants for the next generation of vaccines. Adv Drug Deliv Rev 2016;99:85-96. [DOI:10.1016/j.addr.2015.11.005] [PMID]
15. Gregoriadis G. Immunological adjuvants: a role for liposomes. Immunol Today 1990;11(3):89-97 [DOI:10.1016/0167-5699(90)90034-7] [PMID]
16. Mohammadi A, Abtahi Froushani SM, DelireZh N, Ownagh A. Alum and metoclopramide synergistically enhance cellular and humoral immunity after immunization with heat-killed Salmonella typhimurium vaccine. Int Immunopharmacol 2021;101(Pt A):108185 [DOI:10.1016/j.intimp.2021.108185] [PMID]
17. Jazani NH, Parsania S, Sohrabpour M, Mazloomi E, Karimzad M, Shahabi S. Naloxone and alum synergistically augment adjuvant activities of each other in a mouse vaccine model of Salmonella typhimurium infection. Immunobiology 2011;216(6):744-51. [DOI:10.1016/j.imbio.2010.10.005] [PMID]
18. Ghimire TR. The mechanisms of action of vaccines containing aluminum adjuvants: an in vitro vs in vivo paradigm. Springerplus 2015;4(1):1-18. [DOI:10.1186/s40064-015-0972-0] [PMID] [PMCID]
19. Abtahi Froushani SM, Delirezh N, Hobbenaghi R, Mosayebi G. Synergistic effects of atorvastatin and all-trans retinoic acid in ameliorating animal model of multiple sclerosis. Immunol Invest 2014;43(1):54-68. [DOI:10.3109/08820139.2013.825269] [PMID]
20. Golbahari S, Froushani SMA. Synergistic benefits of nicotine and thymol in alleviating experimental rheumatoid arthritis. Life Sci 2019;239:117037. [DOI:10.1016/j.lfs.2019.117037] [PMID]
21. Kool M, Fierens K, Lambrecht BN. Alum adjuvant: some of the tricks of the oldest adjuvant. Int J Med Microbiol 2012;61(7):927-34. [DOI:10.1099/jmm.0.038943-0] [PMID]
22. Harte C, Gorman AL, McCluskey S, Carty M, Bowie AG, Scott C, et al. Alum activates the bovine NLRP3 inflammasome. Front Immunol 2017;8:1494. [DOI:10.3389/fimmu.2017.01494] [PMID] [PMCID]
23. Shushtari N, Froushani SMA. Caffeine augments the instruction of anti-inflammatory macrophages by the conditioned medium of mesenchymal stem cells. Cell J (Yakhteh) 2017;19(3):415. [PMCID]
24. Orecchioni M, Ghosheh Y, Pramod AB, Ley K. Macrophage polarization: different gene signatures in M1 (LPS+) vs. classically and M2 (LPS-) vs. alternatively activated macrophages. Front Immunol 2019;10:1084. [DOI:10.3389/fimmu.2019.01084] [PMID] [PMCID]
25. Richard SA. Exploring the pivotal immunomodulatory and anti-inflammatory potentials of glycyrrhizic and glycyrrhetinic acids. Mediators Inflamm 2021;2021. [DOI:10.1155/2021/6699560] [PMID] [PMCID]
26. Froushani SMA, Galeh HEG. New insight into the immunomodulatory mechanisms of Tretinoin in NMRI mice. Iran J Basic Med Sci 2014;17(9):632. [PMCID]
27. Muraille E, Leo O, Moser M. TH1/TH2 paradigm extended: macrophage polarization as an unappreciated pathogen-driven escape mechanism? Front Immunol 2014;5:603. [DOI:10.3389/fimmu.2014.00603]
28. Moriyama M, Nakamura S. Th1/Th2 immune balance and other T helper subsets in IgG4-related disease. Curr Top Microbiol Immunol 2017;401:75-83. [DOI:10.1007/82_2016_40] [PMID]
29. Cêtre C, Pierrot C, Cocude C, Lafitte S, Capron A, Capron M, et al. Profiles of Th1 and Th2 cytokines after primary and secondary infection by Schistosoma mansoni in the semipermissive rat host. Infect Immun 1999;67(6):2713-9. [DOI:10.1128/IAI.67.6.2713-2719.1999] [PMID] [PMCID]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







